- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
با سلام خدمت دوستان عزیز...
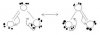
در توجیه ساختار رزونانسی برخی مولکولها مثل O3 یا SO3 یا ... از چه نوع اوربیتال های هیبریدی ای استفاده میکنیم. مثلا اگر فرض کنیم در O3 تمام تمهای اکسیژن از هیبرید sp2 کنند، باید اوربیتال pی باقیمانده در اتم Oی مرکزی باید حاوی یک جفت الکترون باشد و اوربیتال pی باقیمانده در هریک از اتم های کناری باید حاوی یک الکترون باشند. این 3 اوربیتال pی عمود بر محور اوربیتال های sp2 و موازی از پهلو همپوشانی میکنند و در نتیجه 4 الکترون به جریان می افتند. با این تحلیل ما باید انتظار داشته باشیم که دو پیوند دوپیوند پی بوجود آید ولی در واقع این طور نیست. در ضمن نمیتوان مرتبه ی پیوند 1.5 را برای آن اثبات کرد.
حالا تحلیل درستش چه جوریه؟ :roll:
در توجیه ساختار رزونانسی برخی مولکولها مثل O3 یا SO3 یا ... از چه نوع اوربیتال های هیبریدی ای استفاده میکنیم. مثلا اگر فرض کنیم در O3 تمام تمهای اکسیژن از هیبرید sp2 کنند، باید اوربیتال pی باقیمانده در اتم Oی مرکزی باید حاوی یک جفت الکترون باشد و اوربیتال pی باقیمانده در هریک از اتم های کناری باید حاوی یک الکترون باشند. این 3 اوربیتال pی عمود بر محور اوربیتال های sp2 و موازی از پهلو همپوشانی میکنند و در نتیجه 4 الکترون به جریان می افتند. با این تحلیل ما باید انتظار داشته باشیم که دو پیوند دوپیوند پی بوجود آید ولی در واقع این طور نیست. در ضمن نمیتوان مرتبه ی پیوند 1.5 را برای آن اثبات کرد.
حالا تحلیل درستش چه جوریه؟ :roll: