- ارسال ها
- 19
- لایک ها
- 32
- امتیاز
- 0
عناصر تناوب دوم ، از جمله لیتیم ، بریلیم ، بور ، کربن ، نیتروژن و اکسیژن می توانند با فلوئور واکنش داده و جامد های متفاوتی را ایجاد کنند . اکثر این جامد ها جزو جامد های مولکولی هستند . البته در بین جامد های این تناوب ، جامد یونی نیز به چشم می خورد ، لیتیم فلوئورید
 یک جامد یونی خواهد بود که ذرات تشکیل دهنده آن ، کاتیون های لیتیم و آنیون های فلوئورید می باشد . مسلما دمای ذوب و جوش آن از سایر فلوئورید های تناوب دوم بیشتر خواهد بود چون که پیوند یونی حاکم در بین یون های این نمک ازپیوند و یا نیروی واندروالسی فلوئورید های دیگر قوی تر است . اگر بخواهیم فلوئورید های این تناوب را ا زنظر دمای ذوب و جوش با یکدیگر مقایسه کنیم ، ترتیب به این صورت خواهد بود . دمای ذوب :
یک جامد یونی خواهد بود که ذرات تشکیل دهنده آن ، کاتیون های لیتیم و آنیون های فلوئورید می باشد . مسلما دمای ذوب و جوش آن از سایر فلوئورید های تناوب دوم بیشتر خواهد بود چون که پیوند یونی حاکم در بین یون های این نمک ازپیوند و یا نیروی واندروالسی فلوئورید های دیگر قوی تر است . اگر بخواهیم فلوئورید های این تناوب را ا زنظر دمای ذوب و جوش با یکدیگر مقایسه کنیم ، ترتیب به این صورت خواهد بود . دمای ذوب :
 و در مقایسه دمای جوش روند با روند نقطه ذوب فرق خواهد داشت . دمای جوش :
و در مقایسه دمای جوش روند با روند نقطه ذوب فرق خواهد داشت . دمای جوش :
 برای راحتی کار مقایسه می توان ، این ترکیب ها را جفت جفت مقایسه کرد تا روند کلی تفاوت در نقطه ذوب و یا جوش حاصل شود . در مقایسه نقطه ذوب بین لیتیم فلوئوریدو بریلیم فلوئورید که هر دو در دمای معمولی در فاز جامد هستند ، دلیل علمی این است که در بین ذرات لیتیم فلوئورید پیوند یونی قوی حاکم است . در حالی که بریلیم فلورید اجتماعی غول آسا از مولکول های به هم پیوسته بریلیم فلوئورید است که دارای نیروی واندوالسی ( لاندون) می باشد . در مقایسه بین
برای راحتی کار مقایسه می توان ، این ترکیب ها را جفت جفت مقایسه کرد تا روند کلی تفاوت در نقطه ذوب و یا جوش حاصل شود . در مقایسه نقطه ذوب بین لیتیم فلوئوریدو بریلیم فلوئورید که هر دو در دمای معمولی در فاز جامد هستند ، دلیل علمی این است که در بین ذرات لیتیم فلوئورید پیوند یونی قوی حاکم است . در حالی که بریلیم فلورید اجتماعی غول آسا از مولکول های به هم پیوسته بریلیم فلوئورید است که دارای نیروی واندوالسی ( لاندون) می باشد . در مقایسه بین
 و
و
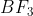 این دلیل را ذکر کنیم که مولکو ل های بور تری فلوئورید ، مولکولی دو بعدی و مسطح بوده و این مولکول های جدا از هم با نیروی لاندون در کنار هم قرار گرفته و در مقایسه با بریلیم فلوئورید ( شبکه عظیم غول آسا ) این نیرو ضعیف تر خواهد بود .
این دلیل را ذکر کنیم که مولکو ل های بور تری فلوئورید ، مولکولی دو بعدی و مسطح بوده و این مولکول های جدا از هم با نیروی لاندون در کنار هم قرار گرفته و در مقایسه با بریلیم فلوئورید ( شبکه عظیم غول آسا ) این نیرو ضعیف تر خواهد بود .
اگر می بینیم که بور تری فلوئورید دمای ذوب بالاتری نسبت به
 دارد ، این است که هر دو مولکول غیر قطبی بوده ولی مولکول مسطح
دارد ، این است که هر دو مولکول غیر قطبی بوده ولی مولکول مسطح
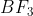 نسبت به مولکول سه بعدی و چهار وجهی
نسبت به مولکول سه بعدی و چهار وجهی
 از تقارن بیشتری برخوردار است و می دانیم که تقارن یکی از عوامل تعیین کننده در نقطه ذوب و انجماد است . و این تقارن در ساختار در
از تقارن بیشتری برخوردار است و می دانیم که تقارن یکی از عوامل تعیین کننده در نقطه ذوب و انجماد است . و این تقارن در ساختار در
 باعث برتری دمای ذوب آن نسبت به مولکول هر چند قطبی ونامتقارن
باعث برتری دمای ذوب آن نسبت به مولکول هر چند قطبی ونامتقارن
 خواهد بود .
خواهد بود .
مولکول
 نیزقطبی می باشد و در بین ذرات آن همچون مولکول
نیزقطبی می باشد و در بین ذرات آن همچون مولکول
 نیروی جاذبه دو قطبی – دوقطبی برقرار است ولی از آن جایی که جرم مولکولی
نیروی جاذبه دو قطبی – دوقطبی برقرار است ولی از آن جایی که جرم مولکولی
 کمتر است پس نیروی لاندون ضعیف تری نسبت به
کمتر است پس نیروی لاندون ضعیف تری نسبت به
 خواهد داشت .
خواهد داشت .
اما مقایسه دمای جوش ، اگر می بینیم که دمای جوش
 برخلاف روند دمای ذوب از دمای جوش
برخلاف روند دمای ذوب از دمای جوش
 بیشتر است می توان دلیل آن را این گونه بیان کرد که مولکول قطبی بوده و دربین ذرات آن نیروی جاذبه دوقطبی – دوقطبی برقرا ر است . البته در کنار همه این مباحث و دلایل نوع شبکه بلور را را نیز اضافه کرد که بلور این مولکول ها از چه آرایش پیروی می کند ، خارج از مقوله این بحث می باشد .
بیشتر است می توان دلیل آن را این گونه بیان کرد که مولکول قطبی بوده و دربین ذرات آن نیروی جاذبه دوقطبی – دوقطبی برقرا ر است . البته در کنار همه این مباحث و دلایل نوع شبکه بلور را را نیز اضافه کرد که بلور این مولکول ها از چه آرایش پیروی می کند ، خارج از مقوله این بحث می باشد .
اگر می بینیم که بور تری فلوئورید دمای ذوب بالاتری نسبت به
مولکول
اما مقایسه دمای جوش ، اگر می بینیم که دمای جوش
آخرین ویرایش توسط مدیر
