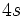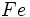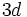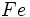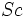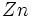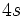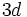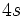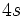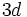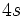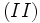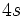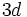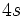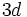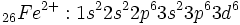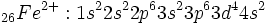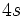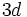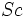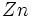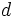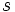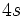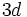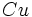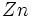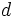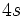[TABLE][TR][TD][hr:6c11e1f0c2][/TD][/TR][TR][TD]
<A href="<A" target=_blank>روشهاي جديد محاسبه بار مؤثر هسته
[JUSTIFY]اسليتر قواعد خود را بنا بر محاسبات مكانيك كوانتومي و بر مبناي اتم ئيدروژن، فرموله كرد. يك هدف مهم آن بود كه قواعد سادهاي براي محاسبه در اختيار قرار دهد. در عمل و هنگام كار با اتمهاي چند الكتروني، ديده ميشود كه اين قواعد ساده، گاهي ايجاد اشتباه ميكند.[/JUSTIFY]
[hr:6c11e1f0c2]<A href="<A" target=_blank>روش كلمانتي و ريموندي
[JUSTIFY]اين روش در سال 1963، توسط دو دانشمند بنامهاي كلمانتي و ريموندي، ارائه شد كه نتايج حاصل از آن در مورد عناصر سبك (از هليم تا كريپتون)، نسبتاً دقيق است. در اين روش علاوه بر تعداد كل الكترونهاي اتم (البته غير از الكترون مورد نظر) و عدد كوآنتومي اصلي، عدد كوآنتومي فرعي نيز در محاسبه ثابت پوششي، دخالت داده ميشود. به بياني ديگر، برعكس روش اسليتر، ثابت پوششي يكساني براي تمام الكترونهاي يك تراز اصلي انرژي، در نظر گرفته نميشود. بلكه تنها براي الكترونهاي هر تراز فرعي (كه اعداد كوآنتومي اصلي و فرعي برابري دارند)، ثابت پوششي، برابر فرض ميشود. براي نمونه، در اين روش، ثابت پوششي الكترونهاي ترازهاي فرعي
و
، يكسان در نظر گرفته نميشوند. علاوه بر آن، برخلاف روش اسليتر، الكترونهايي كه نسبت به الكترون مورد نظر از هسته دورترند و در تراز بالاتري قرار دارند، در اثر پوششي دخالت داده ميشوند. زيرا، به هر حال، مقداري از بار مثبت هسته براي نگهداشتن آنها در اتم، اختصاص دارد. هر چند كه مقدار آن ناچيز باشد، در محاسبات بايد منظور شود. مگر در مواردي كه فاصله تراز بالاتر نسبت به الكترون مورد نظر نسبتاً زياد باشد. كه در آن صورت، اثر پوششي منفي براي الكترونهاي آن تراز در نظر گرفته ميشود. مثلاً الكترونهاي تراز
بر الكترونهاي
اثر پوششي مثبت ولي بر الكترونهاي تراز
كه بسيار دروني است، اثر پوششي منفي دارند.[/JUSTIFY][JUSTIFY]در اين روش، براي محاسبه ثابت پوششي كل الكترونهاي پوشش دهنده، بسته به اينكه الكترون مورد نظر در كدام تراز فرعي قرار داشته باشد، براساس محاسبات مبتني بر معادلات موجي، معادله مجزايي پيشنهاد شده است. براي نمونه، صورت اين معادلات در مورد ترازهاي انرژي
تا
، در زير، نشان داده شده است، كه در آنها،
تعداد الكترونهاي موجود تراز فرعي مورد نظر است.[/JUSTIFY][JUSTIFY]
[/JUSTIFY][JUSTIFY]
[/JUSTIFY][JUSTIFY]
[/JUSTIFY][JUSTIFY]
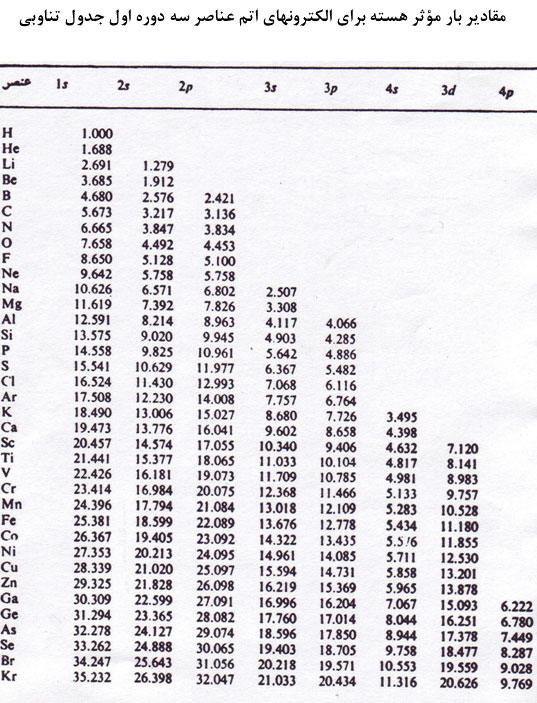
[/JUSTIFY][JUSTIFY]مقدار بدست آمده براي بار مؤثر هسته در مورد هر اتم (يا يون) در روش كلمانتي- ريموندي، همواره از مقداري كه با روش اسليتر بدست ميآيد، بيشتر است (به ويژه براي اتمهاي سنگينتر).[/JUSTIFY][JUSTIFY]جدول زير بار مؤثر هستهاي عناصر 1 تا 36 را بر الكترون ترازهاي انرژي مربوطه نشان ميدهد.[/JUSTIFY]
[center:6c11e1f0c2]
[/center:6c11e1f0c2][/TD]
[hr:6c11e1f0c2]<A href="<A" target=_blank>چند مثال [JUSTIFY]
1.بار مؤثر هستهاي را بر الكترون
پتاسيم مطابق قواعد اسليتر وارد ميشود برابر با 2/2 بود. اما رقم تصحيح شده آن در جدول به 495/31 ميرسد.[/JUSTIFY][JUSTIFY]
2.حال بار مؤثر هستهاي را كه بر الكترون
و
در آهن به روش اسليتر بدست ميآيد، با جدول مقايسه ميكنيم:[/JUSTIFY][/TR][/TABLE][TABLE][TR][TD][/TD][TD]روش كلمانتي و ريموندي[/TD][TD]روش اسليتر [/TD][/TR][TR][TD][center:6c11e1f0c2]ميزان بار مؤثر هستهاي بر الكترون
در
[/center:6c11e1f0c2][/TD][TD]3.75[/TD][TD]5.434 [/TD][/TR][TR][TD][center:6c11e1f0c2]ميزان بار مؤثر هستهاي بر الكترون
در
[/center:6c11e1f0c2][/TD][TD]11.180[/TD][TD]6.25[/TD][/TR][/TABLE]
[JUSTIFY]
3.در سري عناصر واسطه
تا
بايد دقت بيشتري مبذول شود. در هر 10 عنصر ديده ميشود كه تراز انرژي
قبل از ورود الكترون در آنها كمتر از
است. به همين دليل الكترونها ابتدا وارد
ميشوند. ولي از آنجا كه به موازات وارد شدن الكترونها در
، پروتونها نيز در هسته افزايش پيدا ميكنند، از اين رو اثر جذب هسته افزايش مييابد و به دلايلي، تراز انرژي
به طور قابل توجهي افت ميكند و به پايينتر از
ميرسد. [/JUSTIFY][JUSTIFY]بديهي است هنگام خروج الكترون و تشكيل يون آهن
نيز از همين استدلال استفاده ميشود. براي مثال، بار مؤثر هستهاي بر الكترون
در اتم آهن مطابق دادههاي كلمانتي و ريموندي به 434/5 و در مورد
به 800/11 ميرسد. به عبارت ديگر الكترون
تحت اثر جذبي كمتر قرار گرفته و اتصال آن سستتر از
خواهد شد. در نتيجه، هنگام خروج الكترون در يونيزاسيون، ديده ميشود كه آرايش يون آهن
به صورت زير در ميآيد:[/JUSTIFY][JUSTIFY]
[/JUSTIFY][JUSTIFY]و نه به صورت:[/JUSTIFY][JUSTIFY]
[/JUSTIFY][JUSTIFY]
4.هرگاه تفاوت ميان عددهاي اتمي مؤثر روي الكترونهاي
و
را براي 10 عنصر واسطه
تا
مقايسه كنيم، به نتيجه جالبي ميرسيم. اين تفاوت در عناصر اوليه كم است، به همين دليل درگيري اوربيتالهاي
آنها در شركت با اوربيتالهاي
جهت تشكيل انواع عددهاي اكسيداسيون زياد است. براي مثال، عناصر واناديم، كروم و منگنز با كسب انرژي مختصري، هم اوربيتالهاي
و هم اوربيتالهاي
خود را در واكنشهاي شيميايي شركت ميدهند. تفاوت ميان عددهاي اتمي مؤثر، در نيمه دوم سري عناصر واسطه رو به افزايش ميگذارد و تنوع در عددهاي اكسيداسيون آن كمتر ميشود. (مانند
،
). در مورد
، بايد گفت كه مقاومت اوربيتالهاي
براي شركت در والانس به اندازهاي زياد است كه فقط عدد اكسيداسيون + 2 را پيدا ميكند كه مربوط به خروج دو الكترون از
است.[/JUSTIFY]
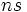
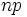
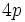
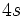
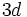
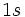
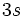
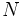
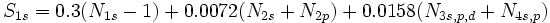
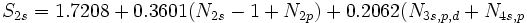
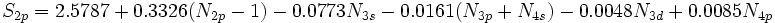
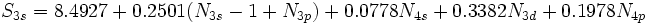
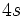
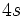
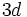
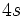 در
در
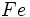 [/center:9c17e9002b][/TD][TD]3.75[/TD][TD]5.434 [/TD][/TR][TR][TD][center:9c17e9002b]ميزان بار مؤثر هستهاي بر الكترون
[/center:9c17e9002b][/TD][TD]3.75[/TD][TD]5.434 [/TD][/TR][TR][TD][center:9c17e9002b]ميزان بار مؤثر هستهاي بر الكترون
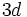 در
در
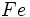 [/center:9c17e9002b][/TD][TD]11.180[/TD][TD]6.25[/TD][/TR][/TABLE]
[/center:9c17e9002b][/TD][TD]11.180[/TD][TD]6.25[/TD][/TR][/TABLE]