سوال جالب-عدد اکسایش
پاسخ : سوال جالب-عدد اکسایش
فرمول مولکولی این یون : S2o3 دو بار منفی هست...:39:
این یون از ترکیب یون سولفیت با گوگرد جامد حاصل میشه...
یون تیوسولفات آرایش چهار وجهی دارد... مثله یون سولفاته که به جای یکی از اکسیژنا گوگرد داره...:3:
عدد اکسایش عنصرهاش با توجه به فرمول ساختاری :
سه تا اکسیژن 2-
دوتا گوگردا 5+ و 1- هستن...:54:
فرمول مولکولی این یون : S2o3 دو بار منفی هست...:39:
این یون از ترکیب یون سولفیت با گوگرد جامد حاصل میشه...
یون تیوسولفات آرایش چهار وجهی دارد... مثله یون سولفاته که به جای یکی از اکسیژنا گوگرد داره...:3:
عدد اکسایش عنصرهاش با توجه به فرمول ساختاری :
سه تا اکسیژن 2-
دوتا گوگردا 5+ و 1- هستن...:54:
- ارسال ها
- 177
- لایک ها
- 112
- امتیاز
- 0
پاسخ : سوال جالب-عدد اکسایش
البته جواب شما غلط است!
فرمول مولکولی این یون : S2o3 دو بار منفی هست...:39:
این یون از ترکیب یون سولفیت با گوگرد جامد حاصل میشه...
یون تیوسولفات آرایش چهار وجهی دارد... مثله یون سولفاته که به جای یکی از اکسیژنا گوگرد داره...:3:
عدد اکسایش عنصرهاش با توجه به فرمول ساختاری :
سه تا اکسیژن 2-
دوتا گوگردا 5+ و 1- هستن...:54:
این یون از ترکیب یون سولفیت با گوگرد جامد حاصل میشه...
یون تیوسولفات آرایش چهار وجهی دارد... مثله یون سولفاته که به جای یکی از اکسیژنا گوگرد داره...:3:
عدد اکسایش عنصرهاش با توجه به فرمول ساختاری :
سه تا اکسیژن 2-
دوتا گوگردا 5+ و 1- هستن...:54:
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
پاسخ : سوال جالب-عدد اکسایش
به نظر من جواب ايشون درسته...
به این دلیل که توی محاسبه ی عدد اکسایش زوج الکترون پیوندی در پیوند ناجور هسته (اتمهای متفاوت) به اتم الکترونگاتیوتر داده میشه و برای پیوند جور هسته (اتمهای یک عنصر) بین اتمها تقسیم میشه و بعد حاصل تفریق تعداد الکترون های لایه ظرفیت حالت پایه عنصر با تعداد الکترون های موجود عدد اکسایش عنصر مورد نظر در نظر گرفته میشه...
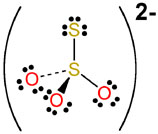
S: 6-1=+5 مركزي
S: 6-7= -1 متصل به S مركزي
O: 6-8=-2
به نظر من جواب ايشون درسته...
به این دلیل که توی محاسبه ی عدد اکسایش زوج الکترون پیوندی در پیوند ناجور هسته (اتمهای متفاوت) به اتم الکترونگاتیوتر داده میشه و برای پیوند جور هسته (اتمهای یک عنصر) بین اتمها تقسیم میشه و بعد حاصل تفریق تعداد الکترون های لایه ظرفیت حالت پایه عنصر با تعداد الکترون های موجود عدد اکسایش عنصر مورد نظر در نظر گرفته میشه...

S: 6-1=+5 مركزي
S: 6-7= -1 متصل به S مركزي
O: 6-8=-2
- ارسال ها
- 177
- لایک ها
- 112
- امتیاز
- 0
پاسخ : سوال جالب-عدد اکسایش
دو اتم گوگرد یون تیوسولفات هم ارز نیستند.این واقعیّت را با واکنش های ترکیب بدست آمده از یک سولفیت و گوگرد رادیواکتیو،(A=35) نمایش داده اند.ترکیب بدست آمده از این واکنش در اثر اسید تجزیه شد، تمام فعالیت های رادیوتکتیوی در گوگرد عنصری مشاهده شد:
SO3(2-) aq +S*(s) ----> S*SO3(2-) aq
S*SO3(2-) +2H(+) -----> S*(s) + SO2 g + H2O
S*= گوگرد رادیو اکتیو
در نتیجه به اتم گوگرد مرکزی معمولا عدد اکسایش 6+ (مانند یون سولفات) و به گوگرد دیگر عدد اکسایش 2- (مربوط به حالت اکسایش اکسیژنی که به جای آن نشسته است) نسبت داده می شود.
منبع: مورتیمر فصل 22 صفحه ی 373
دو اتم گوگرد یون تیوسولفات هم ارز نیستند.این واقعیّت را با واکنش های ترکیب بدست آمده از یک سولفیت و گوگرد رادیواکتیو،(A=35) نمایش داده اند.ترکیب بدست آمده از این واکنش در اثر اسید تجزیه شد، تمام فعالیت های رادیوتکتیوی در گوگرد عنصری مشاهده شد:
SO3(2-) aq +S*(s) ----> S*SO3(2-) aq
S*SO3(2-) +2H(+) -----> S*(s) + SO2 g + H2O
S*= گوگرد رادیو اکتیو
در نتیجه به اتم گوگرد مرکزی معمولا عدد اکسایش 6+ (مانند یون سولفات) و به گوگرد دیگر عدد اکسایش 2- (مربوط به حالت اکسایش اکسیژنی که به جای آن نشسته است) نسبت داده می شود.
منبع: مورتیمر فصل 22 صفحه ی 373
پاسخ : سوال جالب-عدد اکسایش
برای عدد اکسایش، بهترین راه کشیدن ساختاره... ولی برای مولکولایی که دیگه ساختاراشون ملکه ذهن شدن، میشه از فرمول استفاده کرد...
ولی خب توی ساختارایی که دوتا اتم از یک عنصر بهم چسبیدن، چون پیوند وسط نصف نصف تقسیم میشه، باید حواسمون باشه... وگرنه تو بقیش همون فرمولا و این برنامه ها...!
برای عدد اکسایش، بهترین راه کشیدن ساختاره... ولی برای مولکولایی که دیگه ساختاراشون ملکه ذهن شدن، میشه از فرمول استفاده کرد...
ولی خب توی ساختارایی که دوتا اتم از یک عنصر بهم چسبیدن، چون پیوند وسط نصف نصف تقسیم میشه، باید حواسمون باشه... وگرنه تو بقیش همون فرمولا و این برنامه ها...!
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
پاسخ : سوال جالب-عدد اکسایش
در اینکه دو اتم کوگرد هم ارز نیستند هیچ شکی نیست. چون محیط الکترونی اطراف هرکدوم متفاوته و مطمئنا پیوند s-s یک پیوند قطبیه.. اما یه بحثی هست و اونم قرار دادهاست.. مثلا توی همین قاعده ای که زوج الکترون رو میدیم به عنصر الکترونگاتیوتر خوب لزوما اتمها اون الکترونگاتیوی ای که ما از روی جدول میخونیم رو ندارن و حتی ممکنه خیلی تفاوت زیادی داشته باشه.. به خاطر همین طبق قرار داد همونو در نظر میگیریم.. (مثلا توی همین مثال تیوسیانات به خاطر الکترون کشندگی اتمهای اکسیژن به نظر میاد اتم گوگرد مرکزی الکترونگاتیوی بیشتری از اون یکی داشته باشه که یه بار منفی هم داره و تا حدی کمبود الکترونیش برطرف شده..) بهتره از قرار دادهایی استفاده بشه که بعدا به درد آدم بخوره.. کنکور یا المپیاد منبع کتاب درسیه و توی کتاب درسی اومده که پیوند بین دو اتم از یک عنصر ناقطبیه و توی کتاب شیمی پیش هم برای محاسبه عدد اکسایش همون قاعده ای رو آورده که نوشتم.. این مطلبی که آوردید جالب بود اما به نظرم بهتره از یک قاعده کلی استفاده بشه که همیشه جواب میده و به درد میخوره ..
..........................................................
باید به این نکته هم توجه کرد که لزوما دونستن عدد اکسایش یک عنصر توی یک ترکیب برای ما اهمیتی نداره بلکه کاربردش برای ما مهمه..(هرچند که بین عدد اکسایش و بار خالص عناصر تک اتمی رابطه مستقیمی وجود داره) دو تا کاربرد مهمی که داره ایناست: یکی اینکه با توجه به تعداد الکترونها میشه یک واکنش اکسایش کاهش رو تشخیص داد.(با توجه به این اصلا فرقی نمیکنه جفت الکترون رو به کی بدیم یا الکترونها رو چجوری تقسیم کنیم مهم اینه که یک اصول کلی رو برای همه ی گونه ها در نظر بگیریم) یکی هم اینه که چارچوبی تهیه میشه که با توجه به اون میشه تشابهات شیمیایی رو تشخیص داد و خواص رو به هم مربوط کرد. مثلا خواص یونهای فلزات واسطه با عدد اکسایش +2 کاملا مشابهه و همین طور برای +3ها...
دو اتم گوگرد یون تیوسولفات هم ارز نیستند.این واقعیّت را با واکنش های ترکیب بدست آمده از یک سولفیت و گوگرد رادیواکتیو،(a=35) نمایش داده اند.ترکیب بدست آمده از این واکنش در اثر اسید تجزیه شد، تمام فعالیت های رادیوتکتیوی در گوگرد عنصری مشاهده شد:
So3(2-) aq +s*(s) ----> s*so3(2-) aq
s*so3(2-) +2h(+) -----> s*(s) + so2 g + h2o
s*= گوگرد رادیو اکتیو
در نتیجه به اتم گوگرد مرکزی معمولا عدد اکسایش 6+ (مانند یون سولفات) و به گوگرد دیگر عدد اکسایش 2- (مربوط به حالت اکسایش اکسیژنی که به جای آن نشسته است) نسبت داده می شود.
منبع: مورتیمر فصل 22 صفحه ی 373
So3(2-) aq +s*(s) ----> s*so3(2-) aq
s*so3(2-) +2h(+) -----> s*(s) + so2 g + h2o
s*= گوگرد رادیو اکتیو
در نتیجه به اتم گوگرد مرکزی معمولا عدد اکسایش 6+ (مانند یون سولفات) و به گوگرد دیگر عدد اکسایش 2- (مربوط به حالت اکسایش اکسیژنی که به جای آن نشسته است) نسبت داده می شود.
منبع: مورتیمر فصل 22 صفحه ی 373
..........................................................
باید به این نکته هم توجه کرد که لزوما دونستن عدد اکسایش یک عنصر توی یک ترکیب برای ما اهمیتی نداره بلکه کاربردش برای ما مهمه..(هرچند که بین عدد اکسایش و بار خالص عناصر تک اتمی رابطه مستقیمی وجود داره) دو تا کاربرد مهمی که داره ایناست: یکی اینکه با توجه به تعداد الکترونها میشه یک واکنش اکسایش کاهش رو تشخیص داد.(با توجه به این اصلا فرقی نمیکنه جفت الکترون رو به کی بدیم یا الکترونها رو چجوری تقسیم کنیم مهم اینه که یک اصول کلی رو برای همه ی گونه ها در نظر بگیریم) یکی هم اینه که چارچوبی تهیه میشه که با توجه به اون میشه تشابهات شیمیایی رو تشخیص داد و خواص رو به هم مربوط کرد. مثلا خواص یونهای فلزات واسطه با عدد اکسایش +2 کاملا مشابهه و همین طور برای +3ها...

