
در این مقاله با انواع واکنش های شیمیایی آشنا شده و در پایان می توانید با توجه به معادله ی شیمیایی هر واکنش، نوع واکنش را تشخیص دهید.
واکنش های شمیایی زیادی تاکنون شناخته شده است؛ به خاطر شباهتی که بسیاری از واکنش های شیمیایی به هم دارند آن ها را به 5 دسته اصلی طبقه بندی می کنند.
1- سوختن: به واکنش سریع مواد با اکسیژن گفته می شود که با آزاد شدن انرژی (به صورت نور و گرما) همراه باشد.
2- ترکیب (سنتز): واکنشی که در آن دو یا چند ماده ترکیب شده و فرآورده (فرآورده های ) جدید و پیچیده (ترکیبی که تعداد و نوع اتم هایش بیشتر است.) تولید می کنند.
3- تجزیه: واکنشی که در آن یک ماده به مواد ساده تر تبدیل می شود.
4- واکنش های جابجایی (ساده): واکنشی که در آن یک عنصر با یک ماده ی مرکب واکنش داده و یک عنصر جدید در فرآورده آزاد می شود و ماده ی مرکب جدید حاصل می شود.
5- واکنش های جابجایی دو گانه: واکنش بین دو ماده مرکب که در فراورده دو ماده مرکب جدید ایجادشود.
در این قسمت، سعی داریم نکات کوچکی در رابطه با این دسته بندی ها ارائه دهیم.

سوختن: برخی از واکنش های سوختن به شرح ذیل می باشند.
انرژی + آب + دی اکسید کربن
 گاز اکسیژن + هیدرو کربن( a
گاز اکسیژن + هیدرو کربن( a
شایان ذکر است که اگر سوختن هیدرو کربن ها کامل نباشد، بجای دی اکسید کربن، دوده c)) و مونو اکسید کربن تولید خواهد شد.
انرژِی + اکسید نافلز
 گاز اکسیژن + نافلز (b
گاز اکسیژن + نافلز (b
اکسید های نافلزی به اکسید اسیدی نیز مشهورند. این اکسیدهای نافلزی هنگامی که با آب واکنش می دهند، اسید تولید می کنند.
انرژِی + اکسید فلز
 گاز اکسیژن + فلز (c
گاز اکسیژن + فلز (c
فلزات گروه های IA و IIA بجز برلیوم، از واکنش پذیری بالایی برخوردارند. این فلزات هنگامی که با اکسیژن سریع واکنش دهند و گرما و نور تولید کنند؛ سوختن است. ولی اگر به آرامی با اکسیژن واکنش دهند، در این حالت مبادله ی انرژِی احساس نمی شود و واکنش اکسایش نام دارد و سوختن نیست. (مانند زنگ زدن آهن)
اکسید های فلزی به اکسید بازی نیز شهرت دارند، هنگام واکنش این مواد با آب، باز تولید می شود.
ترکیب (سنتز): برخی از واکنش های ترکیب در دسته بندی های متفاوت در این قسمت آورده شده است:
a) بسپارش (پلیمر شدن مواد): طی این واکنش، هزارها مولکول کوچک با هم ترکیب شده و مولکول های درشتی به نام پلیمر تولید می کنند.
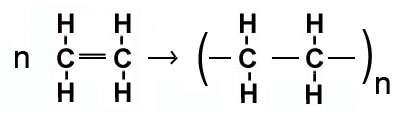
c) واکنش اکسید نافلز در آب نیز نوعی ترکیب است.
اسید اکسیژن دار
 آب + اکسید نافلز
آب + اکسید نافلز
این واکنش ها، جزء واکنش های اکسایش نیستند؛ زیرا در این واکنش ها، عدد اکسایش اتمها تغییر نمی کند.
d) واکنش اکسید فلز در آب نیز نوعی ترکیب است.
باز → آب + اکسید فلز
تجزیه: برخی از واکنش های تجزیه در دسته بندی های متفاوت در این قسمت آورده شده است.a) تجزیه بی کربنات فلزها که واکنش کلی آن ها به صورت زیر است.
بخار آب + دی اکسید کربن + کربنات فلز
 بی کربنات فلز
بی کربنات فلز
تنها فلزهای گروه IA در واکنش فوق شرکت می کنند.
b) تجزیه کربنات فلزها که معادله کلی واکنش شیمیایی آن به صورت زیر است.
دی اکسید کربن + فلز اکسید
 کربنات فلز
کربنات فلز
شایان ذکر است که کربنات فلزهای گروه IA به جز کربنات لیتیم، وقتی حرارت داده شوند، ذوب می شوند و تجزیه نمی شوند. 
c) تجزیه نیترات فلز که معادله کلی واکنش شیمیایی آن ها در دو شرایط متفاوت به شرح ذیل است.
گاز اکسیژن + نیترات فلز
 نیترات فلز
نیترات فلز

گاز اکسیژن + گاز نیتروژن + اکسید فلز
 نیترات فلز
نیترات فلز
d) تجزیه کلرات فلز به معادله شیمیایی 
گاز اکسیژن + کلرید فلز
 کلرات فلز
کلرات فلز
کلرات ها شامل آنیون CLO[SUB]3[/SUB][SUP]-[/SUP] هستند
.
e) تجزیه سولفات فلز به معادله ی شیمیایی
تری اکسید گوگرد + اکسید فلز
 سولفات فلز
سولفات فلز
که سولفات ها شامل آنیون SO[SUB]4[/SUB][SUP]-2[/SUP] می باشد.
f) تجزیه الکتریکی نمک مذاب آب به معادله ی شیمیایی کلی
عنصرهای سازنده
 تجزیه الکتریکی نمک مذاب
تجزیه الکتریکی نمک مذاب
هیدروژن + اکسیژن
 تجزیه الکتریکی آب
تجزیه الکتریکی آب
منبع:وبلاگ شیمی
آخرین ویرایش توسط مدیر
