انرژی پیوند
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
پاسخ : انرژی پیوند
این سوالی هستش که بارها در انجمن پرسیده شده و روش بحث های زیادی شده (درست یا نادرست)، البته در برخی مراجع ، فلوئور حتی از ید هم انرژی پیوند کمتری داره! اما در بیشتر منابع، ترتیبی که شما نوشتین، تأیید میشه! در اینجا سعی می کنیم بحث مبسوطی (با ذکر منبع) ارائه دهیم!
* ضمن اینکه پیشنهاد میشه عنوان رو طوری تغییر بدین که معلوم بشه منظورتون مقایسه انرژی پیوند هالوژن هاست.
......................................................................................................................
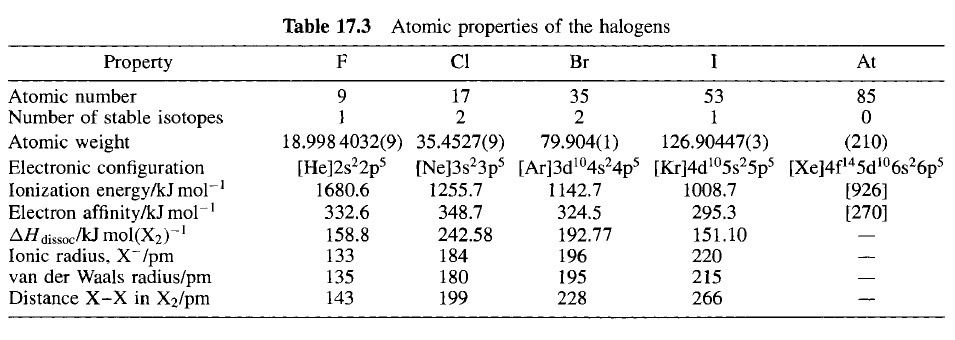
در بین هالوژن ها، الکترون خواهی (قدر مطلق انرژی الکترون خواهی که مقداری مثبت است) برای کلر از همه بیشتر است و مقدار آن برای فلوئور بین کلر و برم قرار دارد. حتی مسئله ی قابل توجه تر اینکه آنتالپی تفکیک پیوند برای F2 از همه کوچکتر است که مقدار آن حدود I2 و کوچک تر از دو سوم مقدار برای Cl2... در این رابطه، می توان توجه کرد به اینکه پیوند N-N در هیدرازین (N2H4) ضعیف تر از پیوند مربوط به P-P است و همینطور پیوند O-O در پروکسیدها ضعیف تر از پیوند مربوط به S-S . این موضوع در سال 1955 توسط R.S.Mulliken (و دیگران) توضیح داده شد. با استفاده از این مقایسه که بخشی از هیبریداسیون pd مقداری خصلت پیوند دوگانه به پیوند P-P و S-S و Cl-Cl می دهد.(لازم به ذکر است که عنصرهای لایه ی اول و دوم مانند N و O و F به اوربیتال d دسترسی ندارند.) در نتیجه آن ها را قوی تر از همتایان ردیف اول خود می کند. با این حال بر اساس کارهای C.A.Coulson (و دیگران) به نظر می رسد که لزومی به استناد اساسی مشارکت اوربیتال های d نیست و ضعیف بودن انرژی پیوند F-F پس از آن، به همپوشانی کاهش یافته ی اوربیتال های پیوندی نسبت داده شد. دافعه ی بین هسته ای قابل توجه و دافعه های نسبتا بزرگ الکترون-الکترون زوج الکترون های غیر پیوندی که در F2 نسبت به Cl2 خیلی بیشتر به هم نزدیک هستند دلایلی بر این مدعاست. (منبع: Chemistry Of Elements, Greenwood, 2nd edition)

......................................................................................................................
یکی از خواص جالب F2 کم بودن چشمگیر آنتالپی تفکیک پیوند آن می باشد که عامل بی نهایت مهمی در واکنش پذیری این مولکول است. برآورد، بر اساس آنتالپی ها تفکیک پیوند سایر هالوژن ها تقریبا 290 kJ/mol را به دست می دهد که نزدیک به دو برابر مقدار واقعی است. پیشنهادات زیادی برای توجیه این مقدار کم به عمل آمده است. احتمال دارد که ضعیف بودن پیوند F-F عمدتا نتیجه ی دافعه ی بین جفت الکترون های غیر پیوندی باشد. اندازه ی کوچک فلوئور این جفت الکترون ها را وقتی پیوند F-F تشکیل می شود به هم نزدیک می کند؛ دافعه های الکتروستاتیکی بین این جفت الکترون های اتم های مجاور سبب می شود پیوند تضعیف شده و طول تعادلی آن به مقدار قابل ملاحظه ای از آنچه که در غیاب چنین دافعه ای مورد انتظار بود، بزرگتر باشد. از نظر اوربیتالی، اندازه کوچک اتم های فلوئور باعث می شود که همپوشانی اوربیتال های مولکولی پیوندی کمتر و همپوشانی اوربیتال های مولکولی ضد پیوندی بیشتر از آن مقدار هایی باشد که در مقایسه با سایر هالوژن ها انتظار می رود. برای مثال، شعاع کووالانسی به دست آمده از سایر ترکیبات فلوئور برابر با 64pm است؛ بنابراین فاصله ی F-F برابر 128pm انتظار می رود. در حالی که فاصله واقعی برابر 143pm است. اکسیژن و نیتروژن در این عدم انطباق، شبیه فلوئور هستند: پیوند های O-O در پروکسیدها و پیوندهای N-N در هیدرازین ها، طویل تر از مجموع شعاع های کوالانسی آنها می باشند و این پیوند ها از پیوند های S-S و P-Pی متناظر در گروههای مربوط به این عناصر ضعیف تر هستند. در رابطه با نیتروژن و اکسیژن احتمال دارد که دافعه ی زوج الکترون های اتم های مجاور نیز نقش عمده ای در تضعیف این پیوند ها داشته باشد.
(منبع: شیمی معدنی میسلر Inorganic Chemistry, Miessler & Tarr)

این سوالی هستش که بارها در انجمن پرسیده شده و روش بحث های زیادی شده (درست یا نادرست)، البته در برخی مراجع ، فلوئور حتی از ید هم انرژی پیوند کمتری داره! اما در بیشتر منابع، ترتیبی که شما نوشتین، تأیید میشه! در اینجا سعی می کنیم بحث مبسوطی (با ذکر منبع) ارائه دهیم!
* ضمن اینکه پیشنهاد میشه عنوان رو طوری تغییر بدین که معلوم بشه منظورتون مقایسه انرژی پیوند هالوژن هاست.
......................................................................................................................

در بین هالوژن ها، الکترون خواهی (قدر مطلق انرژی الکترون خواهی که مقداری مثبت است) برای کلر از همه بیشتر است و مقدار آن برای فلوئور بین کلر و برم قرار دارد. حتی مسئله ی قابل توجه تر اینکه آنتالپی تفکیک پیوند برای F2 از همه کوچکتر است که مقدار آن حدود I2 و کوچک تر از دو سوم مقدار برای Cl2... در این رابطه، می توان توجه کرد به اینکه پیوند N-N در هیدرازین (N2H4) ضعیف تر از پیوند مربوط به P-P است و همینطور پیوند O-O در پروکسیدها ضعیف تر از پیوند مربوط به S-S . این موضوع در سال 1955 توسط R.S.Mulliken (و دیگران) توضیح داده شد. با استفاده از این مقایسه که بخشی از هیبریداسیون pd مقداری خصلت پیوند دوگانه به پیوند P-P و S-S و Cl-Cl می دهد.(لازم به ذکر است که عنصرهای لایه ی اول و دوم مانند N و O و F به اوربیتال d دسترسی ندارند.) در نتیجه آن ها را قوی تر از همتایان ردیف اول خود می کند. با این حال بر اساس کارهای C.A.Coulson (و دیگران) به نظر می رسد که لزومی به استناد اساسی مشارکت اوربیتال های d نیست و ضعیف بودن انرژی پیوند F-F پس از آن، به همپوشانی کاهش یافته ی اوربیتال های پیوندی نسبت داده شد. دافعه ی بین هسته ای قابل توجه و دافعه های نسبتا بزرگ الکترون-الکترون زوج الکترون های غیر پیوندی که در F2 نسبت به Cl2 خیلی بیشتر به هم نزدیک هستند دلایلی بر این مدعاست. (منبع: Chemistry Of Elements, Greenwood, 2nd edition)

......................................................................................................................
یکی از خواص جالب F2 کم بودن چشمگیر آنتالپی تفکیک پیوند آن می باشد که عامل بی نهایت مهمی در واکنش پذیری این مولکول است. برآورد، بر اساس آنتالپی ها تفکیک پیوند سایر هالوژن ها تقریبا 290 kJ/mol را به دست می دهد که نزدیک به دو برابر مقدار واقعی است. پیشنهادات زیادی برای توجیه این مقدار کم به عمل آمده است. احتمال دارد که ضعیف بودن پیوند F-F عمدتا نتیجه ی دافعه ی بین جفت الکترون های غیر پیوندی باشد. اندازه ی کوچک فلوئور این جفت الکترون ها را وقتی پیوند F-F تشکیل می شود به هم نزدیک می کند؛ دافعه های الکتروستاتیکی بین این جفت الکترون های اتم های مجاور سبب می شود پیوند تضعیف شده و طول تعادلی آن به مقدار قابل ملاحظه ای از آنچه که در غیاب چنین دافعه ای مورد انتظار بود، بزرگتر باشد. از نظر اوربیتالی، اندازه کوچک اتم های فلوئور باعث می شود که همپوشانی اوربیتال های مولکولی پیوندی کمتر و همپوشانی اوربیتال های مولکولی ضد پیوندی بیشتر از آن مقدار هایی باشد که در مقایسه با سایر هالوژن ها انتظار می رود. برای مثال، شعاع کووالانسی به دست آمده از سایر ترکیبات فلوئور برابر با 64pm است؛ بنابراین فاصله ی F-F برابر 128pm انتظار می رود. در حالی که فاصله واقعی برابر 143pm است. اکسیژن و نیتروژن در این عدم انطباق، شبیه فلوئور هستند: پیوند های O-O در پروکسیدها و پیوندهای N-N در هیدرازین ها، طویل تر از مجموع شعاع های کوالانسی آنها می باشند و این پیوند ها از پیوند های S-S و P-Pی متناظر در گروههای مربوط به این عناصر ضعیف تر هستند. در رابطه با نیتروژن و اکسیژن احتمال دارد که دافعه ی زوج الکترون های اتم های مجاور نیز نقش عمده ای در تضعیف این پیوند ها داشته باشد.
(منبع: شیمی معدنی میسلر Inorganic Chemistry, Miessler & Tarr)

