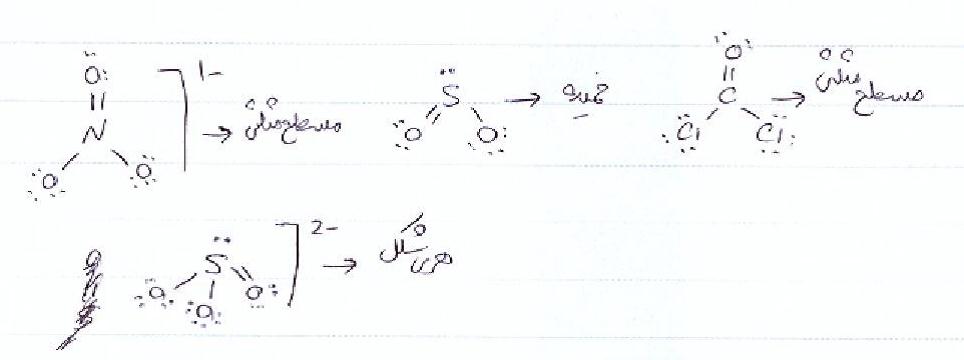
بنابر این نتیجه رو میشه اینطوری دسته بندی کرد:89::
بار موثر هسته مقدار بار مثبتی است که از طرف هسته بر الکترون مورد نظر اعمال می شود و بر حسب واحد نسبی بار الکترون از رابطه زیر قابل محاسبه است:
Z[SUP]* [/SUP]= Z - S
( اثر پوششی الکترونها S ، عدد اتمی Z و بار موثر هسته *Z )
با افزایش عدد اتمی بار موثر هسته نیز افزایش می یابد پس در هر دوره از چپ به راست و در هر گروه از بالا به پایین بار موثر هسته زیاد می شود.
در مقایسه بین اتم و یونهای آن با توجه به اینکه عدد اتمی ثابت است هر چه تعداد الکترون کمتر باشد اثر پوششی الکترونها کمتر و در نتیجه بار موثر هسته بیشتر است.
با افزایش عدد اتمی ( تعداد پروتون ) به همان اندازه تعداد الکترون هم اضافه می شود اما اثر افزایش Z بیشتر از مقدار S است در نتیجه با افزایش Z ، Z[SUP]*[/SUP] نیز افزایش می یابد ، در یک دوره ، به علت ثابت بودن تعداد لایه ، افزایش Z[SUP]*[/SUP] ( از چپ به راست ) موجب کاهش شعاع و افزایش الکترونگاتیوی می شود اما در گروه ( از بالا به پایین ) با افزایش عدد اتمی ، تعداد لایه نیز افزایش می یابد و با توجه به اینکه افزایش Z[SUP]*[/SUP] نمی تواند بر اثر افزایش تعداد لایه غلبه نماید در نتیجه با وجود افزایش بار موثر هسته ، شعاع افزایش و الکترونگاتیوی و انرژی نخستین یونش کاهش می یابد. به جدول زیر دقت نمایید.
مقادیر بار موثر هسته بر الکترونهای اتم عناصر دوره اول و دوم و سدیم و پتاسیم
[TABLE]
[TR]
[TD="bgcolor: transparent"]4S [/TD]
[TD] 3S [/TD]
[TD="width: 67, bgcolor: transparent"] 2P [/TD]
[TD="width: 67, bgcolor: transparent"]2S [/TD]
[TD="width: 78, bgcolor: transparent"]1S [/TD]
[TD="width: 57, bgcolor: transparent"]عنصر[/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 78, bgcolor: transparent"] 000 / 1[/TD]
[TD="width: 57, bgcolor: transparent"]H [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 78, bgcolor: transparent"] 688 / 1[/TD]
[TD="width: 57, bgcolor: transparent"]He [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]279 / 1 [/TD]
[TD="width: 78, bgcolor: transparent"] 691 / 2 [/TD]
[TD="width: 57, bgcolor: transparent"]Li [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]912 / 1 [/TD]
[TD="width: 78, bgcolor: transparent"] 685 / 3 [/TD]
[TD="width: 57, bgcolor: transparent"] Be [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]421 / 2 [/TD]
[TD="width: 67, bgcolor: transparent"]576 / 2 [/TD]
[TD="width: 78, bgcolor: transparent"] 680 / 4 [/TD]
[TD="width: 57, bgcolor: transparent"]B [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]136 / 3 [/TD]
[TD="width: 67, bgcolor: transparent"]217 / 3 [/TD]
[TD="width: 78, bgcolor: transparent"] 673 / 5 [/TD]
[TD="width: 57, bgcolor: transparent"]C [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]834 / 3 [/TD]
[TD="width: 67, bgcolor: transparent"]847 / 3 [/TD]
[TD="width: 78, bgcolor: transparent"] 665 / 6 [/TD]
[TD="width: 57, bgcolor: transparent"]N [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]453 / 4 [/TD]
[TD="width: 67, bgcolor: transparent"]492 / 4 [/TD]
[TD="width: 78, bgcolor: transparent"] 658 / 7 [/TD]
[TD="width: 57, bgcolor: transparent"]O [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]100 / 5 [/TD]
[TD="width: 67, bgcolor: transparent"]128 / 5 [/TD]
[TD="width: 78, bgcolor: transparent"] 650 / 8 [/TD]
[TD="width: 57, bgcolor: transparent"]F [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]758 / 5 [/TD]
[TD="width: 67, bgcolor: transparent"]758 / 5 [/TD]
[TD="width: 78, bgcolor: transparent"] 642 / 9 [/TD]
[TD="width: 57, bgcolor: transparent"]Ne [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"][/TD]
[TD="width: 67, bgcolor: transparent"]507 / 2 [/TD]
[TD="width: 67, bgcolor: transparent"]802 / 6 [/TD]
[TD="width: 67, bgcolor: transparent"]571 / 6 [/TD]
[TD="width: 78, bgcolor: transparent"]626 / 10[/TD]
[TD="width: 57, bgcolor: transparent"]Na [/TD]
[/TR]
[TR]
[TD="width: 67, bgcolor: transparent"]495 / 3 [/TD]
[TD="width: 67, bgcolor: transparent"]680 / 8[/TD]
[TD="width: 67, bgcolor: transparent"]027 / 15
[/TD]
[TD="width: 67, bgcolor: transparent"]006 / 13[/TD]
[TD="width: 78, bgcolor: transparent"]490 / 18 [/TD]
[TD="width: 57, bgcolor: transparent"]K [/TD]
[/TR]
[/TABLE]