---> ( ماراتن محلولها ) <---
amir-tavakoli گفت
ما که از اول نمیدونیم 35 سی سی داریم! ما (20+V) سی سی محلول داریم که مطمئیم V بزرگتر مساوی 5 هستش! (چون 25 سی سی ازش برداشتیم واسه تجزیه تحلیل) شما اون 15 سی سی رو که به دست آوردی و با 20 سی سی جمع کردی از راه حل قبلیت بود که فهمیدی اشتباه بود!
البته اینجا یه احتمال دیگه هم میدیم! چون دو بار 25 سی سی ازش برداشتیم به احتمال زیاد باید V بزرگتر مساوی 30 باشه! ولی خوب ممکنه یه نفر فکر کنه که دوبار پشت سر هم برنداشتیم! اینم فکریه به هر حال!
البته اینجا یه احتمال دیگه هم میدیم! چون دو بار 25 سی سی ازش برداشتیم به احتمال زیاد باید V بزرگتر مساوی 30 باشه! ولی خوب ممکنه یه نفر فکر کنه که دوبار پشت سر هم برنداشتیم! اینم فکریه به هر حال!
سلام
من كه از محاسبات چيزي نفهميدم ولي از توضيحاتت متوجه اشتباهم شدم
ما 0.003 مول HCl در 25 سي سي (0.025 ليتر) محلول داريم (اگه فرض كنيم هيچ واكنشي انجام نشده) و اگه مول HCl موجود توي (V+20) ليتر محلول رو حساب كنيم در واقع مقدار مول HCl توي V ليتر محلول HCl رو حساب كرديم پس اين دو مقدار رو مساوي هم قرار مي ديم و معادله اي كه بدست مياد رو حل مي كنيم:
اما قسمت دوم
بعد از انجام واكنش با نقره نيترات 0.002 مول HCl تو 25 سي سي مونده كه ميشه 0.004 مول تو 50 سي سي كه مولاريته اش ميشه 0.08 مولار
amir-tavakoli گفت
سوال چهارم:
amir-tavakoli گفت
ارتباط میان مولالیته C[SUB]m[/SUB] و مولاریته C[SUB]M [/SUB]را برای محلولی با چگالی d (بر حسب گرم بر سانتی متر مکعب) به دست آورید، اگر جرم یک مول جسم حل شده در آن برابر M باشد.
توجه: یک بار از مولاریته به مولالیته برسید و بار دیگر از مولالیته به مولاریته!
براي بدست آوردن مولاريته از روي مولاليته بايد توجه كنيم كه جرم 1 كيلوگرم آب (حلال) ميشه 1000+C[SUB]m[/SUB]*M گرم محلول
براي بدست آوردن مولاليته از روي مولاريته بايد بدونيم كه در 1 ليتر محلول 1000d-C[SUB]M[/SUB]*M گرم آب (حلال) هستش
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
[center:ccf0940b39]
 [/center:ccf0940b39]
[/center:ccf0940b39]
سوال پنجم:
می خواهیم 50 سی سی محلول H2SO4 یک مولار تهیه کنیم. روی ظرفی که درون انبار داریم نوشته شده 1.1g/cm3=چگالی با 47 درصد خلوص حجمی.
الف)چند سی سی H2SO4 از ظرف درون انبار برای تهیه محلول مورد نظر لازم میباشد؟
ب) غلظت H2SO4 درون ظرف انبار چند مولار است؟
توجه: ناخالصی درون ظرف انبار آب می باشد و چگالی تک تک اعضای درون ظرف انبار 1.1 گرم بر سانتی متر مکعب است.

سوال پنجم:
می خواهیم 50 سی سی محلول H2SO4 یک مولار تهیه کنیم. روی ظرفی که درون انبار داریم نوشته شده 1.1g/cm3=چگالی با 47 درصد خلوص حجمی.
الف)چند سی سی H2SO4 از ظرف درون انبار برای تهیه محلول مورد نظر لازم میباشد؟
ب) غلظت H2SO4 درون ظرف انبار چند مولار است؟
توجه: ناخالصی درون ظرف انبار آب می باشد و چگالی تک تک اعضای درون ظرف انبار 1.1 گرم بر سانتی متر مکعب است.
سلام
اون راهي كه به نظر من رسيد اينه
الف) اول جرم H2SO4 تو يه سي سي محلول تو انبار رو حساب مي كنيم (راستش من اين راه رو با توجه به "توجه" نوشتم و شايد استنباطم از اين جمله غلط باشه!)
=1\;&space;cc\;&space;(mahlool\;&space;anbar)\times&space;(\frac{47\;&space;cc\;&space;H_{2}SO_{4}}{100\;&space;cc\;&space;(mahlool\;&space;anbar)})\times&space;(\frac{1.1\;&space;g\;&space;H_{2}SO_{4}\;&space;}{1\;&space;cc\;&space;H_{2}SO_{4}})=0.517\;&space;g\;&space;H_{2}SO_{4}\;&space;(mahlool\;&space;anbar))
=50\;&space;cc\;&space;(mahlool\;&space;nahaei)\times&space;(\frac{1\;&space;L}{1000\;&space;cc})\times&space;(\frac{1\;&space;mol\;&space;H_{2}SO_{4}}{1\;&space;L\;&space;(mahlool\;&space;nahaei)})\times&space;(\frac{98\;&space;g\;&space;H_{2}SO_{4}}{1\;&space;mol\;&space;H_{2}SO_{4}})\times&space;(\frac{1\;&space;cc\;&space;(mahlool\;&space;anbar)}{0.517\;&space;g\;&space;H_{2}SO_{4}})=9.478\;&space;cc\;&space;(mahlool\;&space;anbar))
\times&space;(\frac{1.1\;&space;g\;&space;H_{2}SO_{4}}{1\;&space;cm^{3}\;&space;H_{2}SO_{4}})\times&space;(\frac{1\;&space;mol\;&space;H_{2}SO_{4}}{98\;&space;g\;&space;H_{2}SO_{4}})=5.276\;&space;M\;&space;H_{2}SO_{4})
اون راهي كه به نظر من رسيد اينه
الف) اول جرم H2SO4 تو يه سي سي محلول تو انبار رو حساب مي كنيم (راستش من اين راه رو با توجه به "توجه" نوشتم و شايد استنباطم از اين جمله غلط باشه!)
حالا هم حجم هر محلول تو انبار كه براي درست كردن محلول نهايي لازمه رو حساب مي كنيم
ب) فرض مي كنيم 1 ليتر از محلول تو انبار داريم (چون همه ي كميت ها مربوط به محلول تو انباره واسه ي كوتاه شدن محاسبات از نوشتن عبارت "mahlool anbar" صرف نظر كردم)
ببخشيد اگه غلط حل كردم




موفق باشيم
سلام به آقا امير و همه ي دوستان
نمي دونم...
راستش من بعد از اينكه جواب رو فرستادم ي چيزي به ذهنم رسيد كه احتمالا غلطه ولي نمي دونم چرا
اگه "توجه" گفته نشده بود ميشد بگيم كه جرم محلول ميشه جرم حلال + جرم آب (؟)
حالا جرم هر ماده هم ميشه چگالي ماده*حجم ماده پس:
+(d_{H_{2}O}\times&space;v_{H_{2}O})\Rightarrow&space;1.1=0.53+0.47d_{H_{2}SO_{4}}\Rightarrow&space;d_{H_{2}SO_{4}}=1.213) يعني چگالي H2SO4 ميشه 1.213 گرم بر سانتي متر مكعب (نمي دونم چرا غلطه و اين جوري نميشه استدلال كرد)
يعني چگالي H2SO4 ميشه 1.213 گرم بر سانتي متر مكعب (نمي دونم چرا غلطه و اين جوري نميشه استدلال كرد)
نمي دونم...
راستش من بعد از اينكه جواب رو فرستادم ي چيزي به ذهنم رسيد كه احتمالا غلطه ولي نمي دونم چرا
اگه "توجه" گفته نشده بود ميشد بگيم كه جرم محلول ميشه جرم حلال + جرم آب (؟)
حالا جرم هر ماده هم ميشه چگالي ماده*حجم ماده پس:
در ضمن مگه ميشه "چگالی تک تک اعضای درون ظرف انبار 1.1 گرم بر سانتی متر مکعب است" آخه آب هم جزء اجزاي محلوله تو انباره ديگه






- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
[center:aa736fd429]
 [/center:aa736fd429]
[/center:aa736fd429]
سوال ششم:
220 گرم محلول سیر شده KNO3 را در دمای 70 درجه سانتی گراد به آرامی سرد میکنیم تا به دمای 40 درجه سانتی گراد برسد. سپس به این محلول 40 گرم آب با دمای 40 درجه سانتی گراد می افزاییم و به سرغت تا دمای 20 درجه سانتی گراد خنک میکنیم. در حالت اول و دوم چه مقدار رسوب تشکیل می شود؟
اطلاعات مسئله:
قبلیت انحلال نمک KNO3 بر حسب گرم در 100 گرم آب دما بر حسب درجه سانتی گراد
120 70
50 40
25 20

سوال ششم:
220 گرم محلول سیر شده KNO3 را در دمای 70 درجه سانتی گراد به آرامی سرد میکنیم تا به دمای 40 درجه سانتی گراد برسد. سپس به این محلول 40 گرم آب با دمای 40 درجه سانتی گراد می افزاییم و به سرغت تا دمای 20 درجه سانتی گراد خنک میکنیم. در حالت اول و دوم چه مقدار رسوب تشکیل می شود؟
اطلاعات مسئله:
قبلیت انحلال نمک KNO3 بر حسب گرم در 100 گرم آب دما بر حسب درجه سانتی گراد
120 70
50 40
25 20
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
ممنون از جواب دوستان! (ولی کاش راه حلتون رو هم مینوشتین!)
..................................................................................................................
مرحله اول)220 گرم محلول سیر شده در دمای 70 درجه داریم... پس 120 گرمش نمکه و 100 گرمش آب... حالا تا دمای 40 درجه سردش میکنیم... قابلیت انحلال پذیری KNO3 توی این دما 50 درجه هستش و چون 100 گرم آب داریم پس محلول فقط میتونه 50 گرم نمک رو نگه داره و 70 گرم ته نشین خواهد شد.
مرحله دوم) 40 گرم آب با همون دمای 40 درجه اضافه میکنیم پس تا اینجا 140 گرم آب 40 درجه و 50 گرم نمک حل شده داریم... ولی محلول سیر نشده هستش و یه مقداری از نمک داخلش حل میشه... با یه محاسبه ی ساده میفهمیم که 140 گرم آب توی دمای 40 درجه میتونه 70 گرم نمک رو تو خودش حل کنه... پس بعد از حل شدن نمک 140 گرم آب و 70 گرم نمک حل شده داریم و 50 گرم هم ته نشین شده باقی مونده... محلول رو تا 20 درجه خنک میکنیم... توی این دما 140 گرم آب میتونه 35 گرم آ رو در خودش حل کنه... پس 35 گرم دیگه به نمک ته نشین شده اضافه میشه و 85 گرم رسوب داریم!
..................................................................................................................
[center:2eedc21d04]
 [/center:2eedc21d04]
[/center:2eedc21d04]
سوال هفتم:
با استفاده از محلول NaOH و HCl (با غلظت مشخص) آزمایشی طراحی کنید که بتوان حجم یک ظرف بد شکل و بی ریخت را محاسبه کرد.
توجه: ابزار کار ما محدودند و حجم های کوچک را اندازه میگیرند! (بورت و پیپت حبابدار 25 میلی لیتری) و نمیتوانیم با پر کردن از آب و محاسبه ی حجم آب ریخته شده، حجم ظرف را محاسبه کنیم! به دنبال روشی در کمترین زمان ممکن هستیم!
..................................................................................................................
مرحله اول)220 گرم محلول سیر شده در دمای 70 درجه داریم... پس 120 گرمش نمکه و 100 گرمش آب... حالا تا دمای 40 درجه سردش میکنیم... قابلیت انحلال پذیری KNO3 توی این دما 50 درجه هستش و چون 100 گرم آب داریم پس محلول فقط میتونه 50 گرم نمک رو نگه داره و 70 گرم ته نشین خواهد شد.
مرحله دوم) 40 گرم آب با همون دمای 40 درجه اضافه میکنیم پس تا اینجا 140 گرم آب 40 درجه و 50 گرم نمک حل شده داریم... ولی محلول سیر نشده هستش و یه مقداری از نمک داخلش حل میشه... با یه محاسبه ی ساده میفهمیم که 140 گرم آب توی دمای 40 درجه میتونه 70 گرم نمک رو تو خودش حل کنه... پس بعد از حل شدن نمک 140 گرم آب و 70 گرم نمک حل شده داریم و 50 گرم هم ته نشین شده باقی مونده... محلول رو تا 20 درجه خنک میکنیم... توی این دما 140 گرم آب میتونه 35 گرم آ رو در خودش حل کنه... پس 35 گرم دیگه به نمک ته نشین شده اضافه میشه و 85 گرم رسوب داریم!
..................................................................................................................
[center:2eedc21d04]

سوال هفتم:
با استفاده از محلول NaOH و HCl (با غلظت مشخص) آزمایشی طراحی کنید که بتوان حجم یک ظرف بد شکل و بی ریخت را محاسبه کرد.
توجه: ابزار کار ما محدودند و حجم های کوچک را اندازه میگیرند! (بورت و پیپت حبابدار 25 میلی لیتری) و نمیتوانیم با پر کردن از آب و محاسبه ی حجم آب ریخته شده، حجم ظرف را محاسبه کنیم! به دنبال روشی در کمترین زمان ممکن هستیم!
حل:
(a=مولاريته سود,b=حجم سود بر حسب ليتر,c=مولاريته هيدروكلريك اسيد,d=حجم اسيد بر حسب ليتر و چون محدود كننده نداريم پس ab=cd)
متناسب با غلظت مولي آنها ,آنها را با هم مخلوط ميكنيم.يعني مثلا اگر يكي از آنها غلظتش 2 برابر ديگري بود بايد حجمش نصف باشد.(بخاطر ظرفت برابر هر دو گونه).در كل طوري واكنش را تنظيم ميكنيم كه محدود كننده و واكش دهنده اضافي نداشته باشيم):
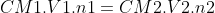
واكنش زير انجام ميگيرد:

مجموع جرم نمك و آب را اندازه ميگيريم و آنرا x ميناميم:
xgمحلول=(18ab)+(58.5ab)
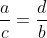
و طبق دو معادله بالا با معلوم شدن b و معلوم بودن a و c ميتوان مقدار d را هم بدست آورد و حاصل b+d ميشود حجم ظرف.
فكر كنم غلط باشه!!!!!!!!!!!!!!!
(a=مولاريته سود,b=حجم سود بر حسب ليتر,c=مولاريته هيدروكلريك اسيد,d=حجم اسيد بر حسب ليتر و چون محدود كننده نداريم پس ab=cd)
متناسب با غلظت مولي آنها ,آنها را با هم مخلوط ميكنيم.يعني مثلا اگر يكي از آنها غلظتش 2 برابر ديگري بود بايد حجمش نصف باشد.(بخاطر ظرفت برابر هر دو گونه).در كل طوري واكنش را تنظيم ميكنيم كه محدود كننده و واكش دهنده اضافي نداشته باشيم):
واكنش زير انجام ميگيرد:
مجموع جرم نمك و آب را اندازه ميگيريم و آنرا x ميناميم:
xgمحلول=(18ab)+(58.5ab)
و طبق دو معادله بالا با معلوم شدن b و معلوم بودن a و c ميتوان مقدار d را هم بدست آورد و حاصل b+d ميشود حجم ظرف.
فكر كنم غلط باشه!!!!!!!!!!!!!!!
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
اگر یه همچین امکاناتی داشتیم، چرا این کار سخت رو انجام بدیم؟؟؟؟؟!!! میتونیم ظرف رو پر از آب کنبم و بعدش آبی که ریختیم رو وزن کنیم و با توجه به چگالی آب حجم ظرف رو پیدا میکنیم! مگه نه؟!!
ولی سوال گفته ما یه همچین امکاناتی نداریم و ابزار کار ما محدودند و حجم های کوچک را اندازه میگیرند! (بورت و پیپت حبابدار 25 میلی لیتری) و نمیتوانیم با پر کردن از آب و محاسبه ی حجم آب ریخته شده، حجم ظرف را محاسبه کنیم! به دنبال روشی در کمترین زمان ممکن هستیم!
ولی سوال گفته ما یه همچین امکاناتی نداریم و ابزار کار ما محدودند و حجم های کوچک را اندازه میگیرند! (بورت و پیپت حبابدار 25 میلی لیتری) و نمیتوانیم با پر کردن از آب و محاسبه ی حجم آب ریخته شده، حجم ظرف را محاسبه کنیم! به دنبال روشی در کمترین زمان ممکن هستیم!

