---> ( ماراتن پیوندها و مولکولها ) <---
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
Re: اوربیتال های هیبریدی کربن در متان
مرسی! منم میخاستم به همین زاویه پیوندی اشاره بشه که شد!
misagh2010 گفت
آخه اگه اوربیتال s و p در کربن ازنظر سطح انرژی با هیبرید شدن ، 4 اوربیتال هم ارز تشکیل ندهد ، کجا میشه توجیه کرد که چهار پیوندکربن در متان هم ارزه
باید هیبرید بشه تا زاویه 109/5 درجه اثبات بشه
باید هیبرید بشه تا زاویه 109/5 درجه اثبات بشه
با اجازه ایجاد کننده تاپیک منم چند سوال هر چند ساده و مشابه میذارم:
[center:917f91971c]
 [/center:917f91971c]
[/center:917f91971c]
سوال A: درستی یا نادرستی این جمله را بررسی کنید(همراه با توجیه):
با توجه به آرایش N که در حالت پایه دارای 3 الکترون جفت نشده است و میتواند 3 پیوند کوالانسی تشکیل دهد در مولکول NH3 اتم N با 3 e خود با اتم هیدروژن پینوند برقرارکرده ونیازی به تشکیل اوربیتال هیبریدی نیست. یکسان بودن پیوندها این پدیده را توجیه میکند. (قرار نیست جمله حتما نادرست باشد!!)
سوال B: دمای ذوب کدام ترکیب کم تر است؟
1)BeCO3
2)MgCO3
3)SrCO3
4)CaCo3
(سوال پایان دوره بسیج...بهار 89....لطفا با دلیل)
سوال C: شکل مولکولی P4S3 را رسم کنید.
سوال D: برای مولکولهای OF2, OCl2,H2O به ترتیب زاویه پیوندی به صورت H2O>OCl2>OF2 پیش بینی می شود در صورتی که عملا ترتیب افزایش زاویه پیوندی به صورت OCl2>H2O>OF2 مشاهده شده است.علت را توضیح دهید.
لطفا سوالات را به ترتیب پاسخ دهید.... از دوستان سال سومی تقاضا میکنم بشتابید

موفق باشید

[center:917f91971c]
سوال A: درستی یا نادرستی این جمله را بررسی کنید(همراه با توجیه):
با توجه به آرایش N که در حالت پایه دارای 3 الکترون جفت نشده است و میتواند 3 پیوند کوالانسی تشکیل دهد در مولکول NH3 اتم N با 3 e خود با اتم هیدروژن پینوند برقرارکرده ونیازی به تشکیل اوربیتال هیبریدی نیست. یکسان بودن پیوندها این پدیده را توجیه میکند. (قرار نیست جمله حتما نادرست باشد!!)
سوال B: دمای ذوب کدام ترکیب کم تر است؟
1)BeCO3
2)MgCO3
3)SrCO3
4)CaCo3
(سوال پایان دوره بسیج...بهار 89....لطفا با دلیل)
سوال C: شکل مولکولی P4S3 را رسم کنید.
سوال D: برای مولکولهای OF2, OCl2,H2O به ترتیب زاویه پیوندی به صورت H2O>OCl2>OF2 پیش بینی می شود در صورتی که عملا ترتیب افزایش زاویه پیوندی به صورت OCl2>H2O>OF2 مشاهده شده است.علت را توضیح دهید.
لطفا سوالات را به ترتیب پاسخ دهید.... از دوستان سال سومی تقاضا میکنم بشتابید

موفق باشید

- ارسال ها
- 652
- لایک ها
- 568
- امتیاز
- 93
سوال A: هیبرید می شه،ولی اصلا مطمئن نیستم! نه به هیبرید شدنش، نه به دلیلم!
سوال B: خوب CO3 که تو همه یکسانه و بار یون ها هم برابره! و دمای ذوب با شعاع یون ها رابطه عکس داره! پس گزینه 3 درسته! چون شعاعش بیشتره و دمای ذوبش کمتره.
سوال C: فک کنم سه تا P با هم سه تا پیوند یگانه می دن و هر کدوم از این سه تا P ها،با یه S پیوند یگانه می دن و هر کدوم از اون S ها پیوند یگانه بر قرار می کنن با اون P چهارمی که تا الان حرفی ازش نزدم!!!

شرمنده،نتونستم ساختارش رو بکشم.
سوال B: خوب CO3 که تو همه یکسانه و بار یون ها هم برابره! و دمای ذوب با شعاع یون ها رابطه عکس داره! پس گزینه 3 درسته! چون شعاعش بیشتره و دمای ذوبش کمتره.
سوال C: فک کنم سه تا P با هم سه تا پیوند یگانه می دن و هر کدوم از این سه تا P ها،با یه S پیوند یگانه می دن و هر کدوم از اون S ها پیوند یگانه بر قرار می کنن با اون P چهارمی که تا الان حرفی ازش نزدم!!!

شرمنده،نتونستم ساختارش رو بکشم.
سوال A :گفتم با توجیه بیش تر فکر کنی به جواب می رسی ... راهنمایی: مثل سوال قبل آقای توکلیه
سوال B: یکم بیش تر دقت کن!!
سوال C: درسته ... چرا می پیچونی؟ همون P4 که روی هر 3 یالش یه S وجود داره=> در صورت علاقه مندی شکلش توی آقابزرگ ملاردی هست.
سوال D: راهنمایی:از پیوند پس دهش (همون Pπ-dπ) استفاده کن برای توجیهش ...
سوال B: یکم بیش تر دقت کن!!
سوال C: درسته ... چرا می پیچونی؟ همون P4 که روی هر 3 یالش یه S وجود داره=> در صورت علاقه مندی شکلش توی آقابزرگ ملاردی هست.
سوال D: راهنمایی:از پیوند پس دهش (همون Pπ-dπ) استفاده کن برای توجیهش ...
- ارسال ها
- 652
- لایک ها
- 568
- امتیاز
- 93
سوال A ؟؟

در مولکولهایی مانند NH3 می توان تصور کرد که اتم نیتروژن از اوربیتالهای هیبریدی SP3 استفاده کرده است، که یکی از آنها توسط یک جفت الکترون غیر مشترک اشغال شده است. اتمهای مولکول NH3 یک هرم مثلثی تشکیل میدهند. ولی آرایش 4 اوربیتال N تقریبا به صورت یک 4 وجهی است و زاویه پیوند برابر با ˚ 107 و ´3 میباشد.

در مولکولهایی مانند NH3 می توان تصور کرد که اتم نیتروژن از اوربیتالهای هیبریدی SP3 استفاده کرده است، که یکی از آنها توسط یک جفت الکترون غیر مشترک اشغال شده است. اتمهای مولکول NH3 یک هرم مثلثی تشکیل میدهند. ولی آرایش 4 اوربیتال N تقریبا به صورت یک 4 وجهی است و زاویه پیوند برابر با ˚ 107 و ´3 میباشد.
برای جواب به قسمت D سوال اگه اشتباه نکنم میشه این رو گفت که امیدوارم توضیحم مبهم و اشتباه نباشه)
امیدوارم توضیحم مبهم و اشتباه نباشه)
چون با افزایش فاصله ی دو مرکز اتم محیطی زاویه ی پیوندی نیز افزایش می یابد( باتوجه به روابط مثلثات) پس میتوان به نتیجه ی مورد نظر رسید یعنی
OCl2>H2O>OF2
!(با توجه به شکلهای زیر)

برای مقایسه ی H2O و OF2 این رو هم میشه گفت: چون قطبیت O...F از قطبیت پیوند O...H کمتره پسبار جزئی روی اتم محیطی F کمتره پس نیروی دافعه بین اتمهای محیطی کمترمیشه پس زاویه ی پیوند OF2 از زاویه پیوندی H2O کمتره!!!!اما برای OCl2 چون اتم Cl شعاعش در مقایسه با شعاع اتم O به میزان قابل توجهی بیشتره تاثیر شعاع از تاثیر الکترونگاتیوی خیلی بیشتره!!!
چون با افزایش فاصله ی دو مرکز اتم محیطی زاویه ی پیوندی نیز افزایش می یابد( باتوجه به روابط مثلثات) پس میتوان به نتیجه ی مورد نظر رسید یعنی
OCl2>H2O>OF2
!(با توجه به شکلهای زیر)

برای مقایسه ی H2O و OF2 این رو هم میشه گفت: چون قطبیت O...F از قطبیت پیوند O...H کمتره پسبار جزئی روی اتم محیطی F کمتره پس نیروی دافعه بین اتمهای محیطی کمترمیشه پس زاویه ی پیوند OF2 از زاویه پیوندی H2O کمتره!!!!اما برای OCl2 چون اتم Cl شعاعش در مقایسه با شعاع اتم O به میزان قابل توجهی بیشتره تاثیر شعاع از تاثیر الکترونگاتیوی خیلی بیشتره!!!
kiana74 گفت
برای جواب به قسمت D سوال اگه اشتباه نکنم میشه این رو گفت که امیدوارم توضیحم مبهم و اشتباه نباشه)
امیدوارم توضیحم مبهم و اشتباه نباشه)
چون با افزایش فاصله ی دو مرکز اتم محیطی زاویه ی پیوندی نیز افزایش می یابد( باتوجه به روابط مثلثات) پس میتوان به نتیجه ی مورد نظر رسید یعنی
OCl2>H2O>OF2
!(با توجه به شکلهای زیر)

برای مقایسه ی H2O و OF2 این رو هم میشه گفت: چون قطبیت O...F از قطبیت پیوند O...H کمتره پسبار جزئی روی اتم محیطی F کمتره پس نیروی دافعه بین اتمهای محیطی کمترمیشه پس زاویه ی پیوند OF2 از زاویه پیوندی H2O کمتره!!!!اما برای OCl2 چون اتم Cl شعاعش در مقایسه با شعاع اتم O به میزان قابل توجهی بیشتره تاثیر شعاع از تاثیر الکترونگاتیوی خیلی بیشتره!!!
چون با افزایش فاصله ی دو مرکز اتم محیطی زاویه ی پیوندی نیز افزایش می یابد( باتوجه به روابط مثلثات) پس میتوان به نتیجه ی مورد نظر رسید یعنی
OCl2>H2O>OF2
!(با توجه به شکلهای زیر)

برای مقایسه ی H2O و OF2 این رو هم میشه گفت: چون قطبیت O...F از قطبیت پیوند O...H کمتره پسبار جزئی روی اتم محیطی F کمتره پس نیروی دافعه بین اتمهای محیطی کمترمیشه پس زاویه ی پیوند OF2 از زاویه پیوندی H2O کمتره!!!!اما برای OCl2 چون اتم Cl شعاعش در مقایسه با شعاع اتم O به میزان قابل توجهی بیشتره تاثیر شعاع از تاثیر الکترونگاتیوی خیلی بیشتره!!!
اما درباره ي دليل اولتون باهات موافق نيستم
aqaie bahman Bazargani dar ketab teste shmi 2 entesharate andishe sazan sale 84 گفت
افزايش طول پيوندها موجب كاهش اندازه ي زاويه ي پيوندي ميشود زيرا اگر در گلوله را در نظر بگيريم كه بار الكتريكي همنام و برابر داشته و هر يك به نخي بسته شده باشند كه به فاصله ي مساوي از محل گره (يعني طول نخ ها يكسان است) رها شوند اين دو گلوله بسته به مقدار باري كه دارند يكديگر را دفع مي كنند و به فاصله l از يكديگر قرار مي گيرند و زاويه ي معيني بين نخ ها در محل گره تشكيل مي شود حال اگر همين آزمايش را بار ديگر تكرار كنيم اما اين بار طول نخ ها را بلند تر انتخاب كنيم چون بار گلوله ها ثابت مانده است باز هم در همان فاصله ي l قرار خواهند گرفت اما چون فاصله ي گلوله ها تا نقطه ي گره بيشتر شده است به وضوح مي توان دريافت كه اين بار زاويه بين نخ ها كوچكتر خواهد بود همين وضعيت در مورد دو جفت الكترون پيوندي كه در نقش همين دو گلوله ي باردار عمل مي كنند و طول پيوندها نيز حكم همان نخ ها را دارند وجود دارد پس هر چه هر طول پيوندها افزايش يابد زاويه ي پيوندي نيز كاهش ميابد...
... عامل اساسي در افزايش زاويه پيوندي Cl2O امكان تشكيل پيوند دوگانه بين كلر و اكسيژن (پي پاي دي پاي) است كه به دليل كوتاهي پيوند Cl-O تشكيل مي شود در ضمن با شركت يك جفت از الكترون هاي ناپيوندي اكسيژن در تشكيل پيوند پاي با كلر تنها يك جفت الكترون هاي ناپيوندي روي اكسيژن باقي مي ماند كه دافعه ي الكترواستاتيكي كمتري بر الكترون هاي پيوندي وارد مي كند كه اين عامل ديگري براي بزرگ بودن زاويه پيوندي در Cl2O است
... عامل اساسي در افزايش زاويه پيوندي Cl2O امكان تشكيل پيوند دوگانه بين كلر و اكسيژن (پي پاي دي پاي) است كه به دليل كوتاهي پيوند Cl-O تشكيل مي شود در ضمن با شركت يك جفت از الكترون هاي ناپيوندي اكسيژن در تشكيل پيوند پاي با كلر تنها يك جفت الكترون هاي ناپيوندي روي اكسيژن باقي مي ماند كه دافعه ي الكترواستاتيكي كمتري بر الكترون هاي پيوندي وارد مي كند كه اين عامل ديگري براي بزرگ بودن زاويه پيوندي در Cl2O است
میشه درباره ی این جمله :"عامل اساسي در افزايش زاويه پيوندي Cl2O امكان تشكيل پيوند دوگانه بين كلرو اكسيژن (پي پاي دي پاي) است كه به دليل كوتاهي پيوند Cl-O تشكيل مي شود" بیشتر توضیح بدید!
"افزايش طول پيوندها موجب كاهش اندازه ي زاويه ي پيوندي ميشود زيرا اگر درگلوله را در نظر بگيريم كه بار الكتريكي همنام و برابر داشته و هر يك بهنخي بسته شده باشند كه به فاصله ي مساوي از محل گره (يعني طول نخ ها يكساناست) رها شوند اين دو گلوله بسته به مقدار باري كه دارند يكديگر را دفع ميكنند و به فاصله l از يكديگر قرار مي گيرند و زاويه ي معيني بين نخ ها درمحل گره تشكيل مي شود حال اگر همين آزمايش را بار ديگر تكرار كنيم اما اينبار طول نخ ها را بلند تر انتخاب كنيم چون بار گلوله ها ثابت مانده استباز هم در همان فاصله ي l قرار خواهند گرفت اما چون فاصله ي گلوله ها تانقطه ي گره بيشتر شده است به وضوح مي توان دريافت كه اين بار زاويه بين نخها كوچكتر خواهد بود همين وضعيت در مورد دو جفت الكترون پيوندي كه در نقشهمين دو گلوله ي باردار عمل مي كنند و طول پيوندها نيز حكم همان نخ ها رادارند وجود دارد پس هر چه هر طول پيوندها افزايش يابد زاويه ي پيوندي نيزكاهش ميابد..."
حرفی که من زدم درباره ی شعاع اتم محیطی بود که مانع زیاد نزدیک شدن دو اتم به هم میشه دو اتم Cl تا حدی میتونن بهم نزدیک شن که ابرهای الکترونیشون در هم فرو نره پس یه عامل بازدارنده برای نزدیکیه دو اتم Cl و زیاد شدن زاویه ی پیوندی و من تو توضیح اصلا کاری به طول پیوند Cl...O نداشتم اگه درست متوجه شده باشم منظور شما از نخها پیوند Cl...O هست!
به این شکل توجه کنید شاید مفهوم حرفمو برسونه:

"افزايش طول پيوندها موجب كاهش اندازه ي زاويه ي پيوندي ميشود زيرا اگر درگلوله را در نظر بگيريم كه بار الكتريكي همنام و برابر داشته و هر يك بهنخي بسته شده باشند كه به فاصله ي مساوي از محل گره (يعني طول نخ ها يكساناست) رها شوند اين دو گلوله بسته به مقدار باري كه دارند يكديگر را دفع ميكنند و به فاصله l از يكديگر قرار مي گيرند و زاويه ي معيني بين نخ ها درمحل گره تشكيل مي شود حال اگر همين آزمايش را بار ديگر تكرار كنيم اما اينبار طول نخ ها را بلند تر انتخاب كنيم چون بار گلوله ها ثابت مانده استباز هم در همان فاصله ي l قرار خواهند گرفت اما چون فاصله ي گلوله ها تانقطه ي گره بيشتر شده است به وضوح مي توان دريافت كه اين بار زاويه بين نخها كوچكتر خواهد بود همين وضعيت در مورد دو جفت الكترون پيوندي كه در نقشهمين دو گلوله ي باردار عمل مي كنند و طول پيوندها نيز حكم همان نخ ها رادارند وجود دارد پس هر چه هر طول پيوندها افزايش يابد زاويه ي پيوندي نيزكاهش ميابد..."
حرفی که من زدم درباره ی شعاع اتم محیطی بود که مانع زیاد نزدیک شدن دو اتم به هم میشه دو اتم Cl تا حدی میتونن بهم نزدیک شن که ابرهای الکترونیشون در هم فرو نره پس یه عامل بازدارنده برای نزدیکیه دو اتم Cl و زیاد شدن زاویه ی پیوندی و من تو توضیح اصلا کاری به طول پیوند Cl...O نداشتم اگه درست متوجه شده باشم منظور شما از نخها پیوند Cl...O هست!
به این شکل توجه کنید شاید مفهوم حرفمو برسونه:

- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
mehrafshan گفت
ولی یه سوال: چرا این P4S3 با اون حلقه ی 3تایی P پایداره؟؟؟


[center:efa9e158e1]
kiana74 گفت
میشه درباره ی این جمله :"عامل اساسي در افزايش زاويه پيوندي Cl2O امكان تشكيل پيوند دوگانه بين كلرو اكسيژن (پي پاي دي پاي) است كه به دليل كوتاهي پيوند Cl-O تشكيل مي شود" بیشتر توضیح بدید!
1) پیوند O---Cl مقداری خصلت دوگانه پیدا میکنه.
2) از فعالیت جفت الکترونهای غیر پیوندی کاسته میشه (آزادی کمتری دارن)
3) طول پیوند O---Cl کمتر از مقدار پیش بینی شده میشه...(کاهش دافعه ی هسته ها با افزایش چگالی ابر الکترونی بین دو هسته)
4) دافعه ی بین پیوندهای O---Cl بیشتر میشه
و ...
همه ی اینا باعث افزایش زاویه پیوندی میشه... ولی چون زاویه پیوندی آنچنان تغییر چشم گیری نمیکنه معلومه که خیلی تأثیر آنچنانی ندارن... ما فقط به دنبال توجیه شواهد تجربی هستیم...
- ارسال ها
- 652
- لایک ها
- 568
- امتیاز
- 93
فک کنم بهتره سوالم رو تصحیح کنم.

ممنون آقای توکلی،شما راست می گید، ناپایداره!
ولی چرا اصلا P4S3 با وجود اون حلقه ی ناپایدار وجود داره و می تونه تشکیل بشه و چرا اصلا یه همچین ساختاری براش رسم می شه؟؟؟

منظورم اینه که می شه ساختاری براش کشید که یه همچین حلقه ی سه تایی تشکیل نشه و همه به اوکتت رسیده باشن!پس چرا ساختارش اینه؟؟؟

شاید دارم چرت می گم، ولی واقعا واسم سواله!!!


ممنون آقای توکلی،شما راست می گید، ناپایداره!
ولی چرا اصلا P4S3 با وجود اون حلقه ی ناپایدار وجود داره و می تونه تشکیل بشه و چرا اصلا یه همچین ساختاری براش رسم می شه؟؟؟

منظورم اینه که می شه ساختاری براش کشید که یه همچین حلقه ی سه تایی تشکیل نشه و همه به اوکتت رسیده باشن!پس چرا ساختارش اینه؟؟؟

شاید دارم چرت می گم، ولی واقعا واسم سواله!!!

سلام
منظور من كه نه منظور آقاي بازرگاني "از نخها پیوند Cl...O نيست!". منظور ايشون در حالت كلي هست كه اكثرا افزايش طول پيوند باعث كاهش زاويه ي پيوندي ميشه...
در نگاه اول ايم طور به نظر مياد كه "هر چه شعاع اتم هاي محيطي بزرگتر بشه زاويه پيوندي هم بزرگتره" اين حرف تا حدي درسته اما يادتون باشه كه هر چي شعاع اتم بزرگتر باشه طول پيوند هم بيشتر ميشه كه اين باعث كاهش زاويه ميشه و در ضمن هر چي شعاع اتم هاي محيطي بزرگتر باشن الكترونگاتيوي شون كمتره اين (معمولا) باعث كمتر شدن اختلاف الكترونگاتيوي اتم ها با اتم مركزي ميشه و هر چي اختلاف الكترونگاتيوي اتم ها با اتم مركزي كمتر باشه زوج الكترون هاي ناپيوندي اتم مركزي (اگه داشته باشه) آزاد ترن و اتم هاي محيطي رو فشرده تر ميكنن كه باعث كمتر شدن زاويه ميشه مثل H2O و OF2 كه اگر چه فلوئور از هيدروژن بزرگتره ولي چون اثر اين دو تا عامل بيشتره زاويه ي OF2 از H2O كوچكتره
ولي اگه جايي هم باشه كه اثر اين دو تا عامل كم باشه بزرگتر بودن اتم محيطي باعث بزرگتر شدن زاويه پيوندي ميشه مثل AsBr3 و AsI3 كه چون الكترونگاتيوي اتم برم (2.8) و اتم يد (2.5) تفاوت چنداني ندارد و طول پيوند (As-Br (233 pm تفاوت زيادي با طول پيوند (As-I (254 pm ندارد تاثير افزايش حجم غلبه مي كنه و زاويه ي پيوندي در مولكول AsI3 بزرگتر ميشه
به طور كلي تو اندازه ي زاويه پيوندي چند عامل هستن كه با هم رقابت مي كنن كه توي هر مولكولي هم تاثير اين عوامل متفاوته و متاسفانه معمولا هم تا جواب درست رو ندونيم نمي تونيم پيش بيني درستي بكنيم و يه زاويه رو بايد تجربي بدست بيارن و ما توجيهش كنيم
منظور من كه نه منظور آقاي بازرگاني "از نخها پیوند Cl...O نيست!". منظور ايشون در حالت كلي هست كه اكثرا افزايش طول پيوند باعث كاهش زاويه ي پيوندي ميشه...
در نگاه اول ايم طور به نظر مياد كه "هر چه شعاع اتم هاي محيطي بزرگتر بشه زاويه پيوندي هم بزرگتره" اين حرف تا حدي درسته اما يادتون باشه كه هر چي شعاع اتم بزرگتر باشه طول پيوند هم بيشتر ميشه كه اين باعث كاهش زاويه ميشه و در ضمن هر چي شعاع اتم هاي محيطي بزرگتر باشن الكترونگاتيوي شون كمتره اين (معمولا) باعث كمتر شدن اختلاف الكترونگاتيوي اتم ها با اتم مركزي ميشه و هر چي اختلاف الكترونگاتيوي اتم ها با اتم مركزي كمتر باشه زوج الكترون هاي ناپيوندي اتم مركزي (اگه داشته باشه) آزاد ترن و اتم هاي محيطي رو فشرده تر ميكنن كه باعث كمتر شدن زاويه ميشه مثل H2O و OF2 كه اگر چه فلوئور از هيدروژن بزرگتره ولي چون اثر اين دو تا عامل بيشتره زاويه ي OF2 از H2O كوچكتره
ولي اگه جايي هم باشه كه اثر اين دو تا عامل كم باشه بزرگتر بودن اتم محيطي باعث بزرگتر شدن زاويه پيوندي ميشه مثل AsBr3 و AsI3 كه چون الكترونگاتيوي اتم برم (2.8) و اتم يد (2.5) تفاوت چنداني ندارد و طول پيوند (As-Br (233 pm تفاوت زيادي با طول پيوند (As-I (254 pm ندارد تاثير افزايش حجم غلبه مي كنه و زاويه ي پيوندي در مولكول AsI3 بزرگتر ميشه
به طور كلي تو اندازه ي زاويه پيوندي چند عامل هستن كه با هم رقابت مي كنن كه توي هر مولكولي هم تاثير اين عوامل متفاوته و متاسفانه معمولا هم تا جواب درست رو ندونيم نمي تونيم پيش بيني درستي بكنيم و يه زاويه رو بايد تجربي بدست بيارن و ما توجيهش كنيم
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
mehrafshan گفت
فک کنم بهتره سوالم رو تصحیح کنم.

ممنون آقای توکلی،شما راست می گید، ناپایداره!
ولی چرا اصلا P4S3 با وجود اون حلقه ی ناپایدار وجود داره و می تونه تشکیل بشه و چرا اصلا یه همچین ساختاری براش رسم می شه؟؟؟

منظورم اینه که می شه ساختاری براش کشید که یه همچین حلقه ی سه تایی تشکیل نشه و همه به اوکتت رسیده باشن!پس چرا ساختارش اینه؟؟؟

شاید دارم چرت می گم، ولی واقعا واسم سواله!!!


ممنون آقای توکلی،شما راست می گید، ناپایداره!
ولی چرا اصلا P4S3 با وجود اون حلقه ی ناپایدار وجود داره و می تونه تشکیل بشه و چرا اصلا یه همچین ساختاری براش رسم می شه؟؟؟

منظورم اینه که می شه ساختاری براش کشید که یه همچین حلقه ی سه تایی تشکیل نشه و همه به اوکتت رسیده باشن!پس چرا ساختارش اینه؟؟؟

شاید دارم چرت می گم، ولی واقعا واسم سواله!!!

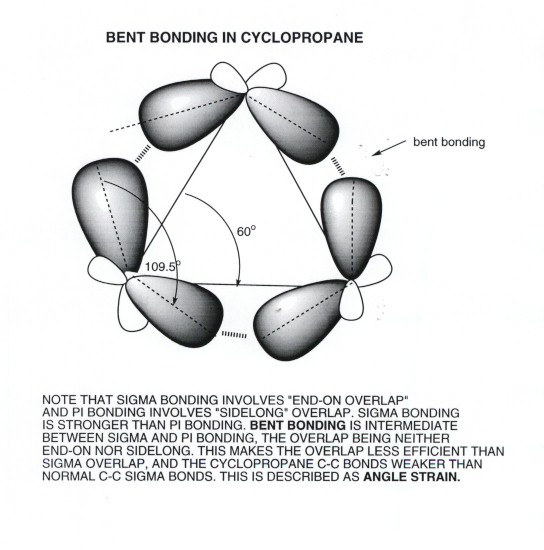
حالا اینکه چیزی نیست، ما سیکلوپروپن هم داریم که فشار زاویه ایش 60 درجس!
- ارسال ها
- 652
- لایک ها
- 568
- امتیاز
- 93
بله، می دونم که سیکلوپروپن هم وجود داره و ناپایداره!
می گم اگه ساختارایی که می شه واسه P4S3 رسم کرد رو مقایسه کنیم، ساختار های با فشار زاویه ایه کمترم هست!
البته شما راست می گید که دیدن که به طوره تجربی چه شکلیه، ولی واقعا واسم جایه تعجبه! آخه سیکلو پروپن با اون درجه سیرنشدگی و با یه حلقه،فقط با یه
ساختار رسم می تونه بشه، ولی این نه!! و در عینه حال ساختار های دیگه می تونن از این پایدار تر باشن!(همون بحث فشار زاویه ای و ...)

می گم اگه ساختارایی که می شه واسه P4S3 رسم کرد رو مقایسه کنیم، ساختار های با فشار زاویه ایه کمترم هست!
البته شما راست می گید که دیدن که به طوره تجربی چه شکلیه، ولی واقعا واسم جایه تعجبه! آخه سیکلو پروپن با اون درجه سیرنشدگی و با یه حلقه،فقط با یه
ساختار رسم می تونه بشه، ولی این نه!! و در عینه حال ساختار های دیگه می تونن از این پایدار تر باشن!(همون بحث فشار زاویه ای و ...)



