.> ماراتون شیمی تجزیه! <.
- ارسال ها
- 135
- لایک ها
- 22
- امتیاز
- 0
سلام ... دوستان خوب نيگا كنين چرا ما نميتونيم آمونيوم رو تو آب به عنوان اسيد تيتر كنيم ؟؟؟؟

علت در اينجاست كه به دليل ثابت تعادل كوچك خنثي شدن آمونيوم با OH منحني تيتراسيون تيز نيس و به اصطلاح نقطه پاياني گمه و قايل تشخيص نيس ... ( وا3 ياد آوري عرض ميكنم كه 2 عامل ثابت تعادل و غلظت تيتران و آناليت به طور مستقيم بر شيب منحني در حوالي هم عرضي تاثير ميذارن )
خوب حالا ما بايد سعي كنيم با حلال محيطي ايجاد كنيم كه بازي قوي تر از OH بتونه توش حضور داشته باشه ... اين كار مسلاما با انتخاب حلالي ميسرهههه كه باز تو محيطش از OH قوي تر باشه ... چون ميدونين قوي ترين بازي كه حلال ميتونه تو خودش نگه داره بازه مزدوجشه ( وگر نه اگه باز قوي تر باشه در ميره ميره ميشه م3 باز مزدوج حلال ) اينو ميدونين كه بش ميگن اثر هم تراز كنندگي ....
با اين اوصاف جواب صحيح گزينه ي 2 آمونياكه .... م3 اين ميمونه كه H رو تو محيط آبي با OH تيتر كني و در اين حالته كه ثابت تعادل بزرگ و نقطه هم عرضي قابل تشخي3
البته ميبخشيد ... شما خودتون استاديد ....



علت در اينجاست كه به دليل ثابت تعادل كوچك خنثي شدن آمونيوم با OH منحني تيتراسيون تيز نيس و به اصطلاح نقطه پاياني گمه و قايل تشخيص نيس ... ( وا3 ياد آوري عرض ميكنم كه 2 عامل ثابت تعادل و غلظت تيتران و آناليت به طور مستقيم بر شيب منحني در حوالي هم عرضي تاثير ميذارن )
خوب حالا ما بايد سعي كنيم با حلال محيطي ايجاد كنيم كه بازي قوي تر از OH بتونه توش حضور داشته باشه ... اين كار مسلاما با انتخاب حلالي ميسرهههه كه باز تو محيطش از OH قوي تر باشه ... چون ميدونين قوي ترين بازي كه حلال ميتونه تو خودش نگه داره بازه مزدوجشه ( وگر نه اگه باز قوي تر باشه در ميره ميره ميشه م3 باز مزدوج حلال ) اينو ميدونين كه بش ميگن اثر هم تراز كنندگي ....
با اين اوصاف جواب صحيح گزينه ي 2 آمونياكه .... م3 اين ميمونه كه H رو تو محيط آبي با OH تيتر كني و در اين حالته كه ثابت تعادل بزرگ و نقطه هم عرضي قابل تشخي3
البته ميبخشيد ... شما خودتون استاديد ....


- ارسال ها
- 135
- لایک ها
- 22
- امتیاز
- 0
2رستتت ميفرمايين ... من اصلا حواسم نبود كه قراره حتما NaOH تيتران باشه ... فكر كنم علت اينكه يه اسيد تو محيط آپروتيك قطبي قوي تره اين باشه كه قطب منفي حلال ميره سراغ H اسيدا و باعث ميشه راحت تر كنده بشه و اسيد قوي تري واي3 ( اين يكي تيكيه خودمه
 ) 2رسته ؟؟؟
) 2رسته ؟؟؟
يني جواب ميشه فرمالدهيد (همون طور كه فرموديد)
در ضمن فكر كنم منظورتون اين بود تو پست بالا ( مثل این می مونه که بخوایم NH4 رو تو آب با NaOAc تیتر کنیم... درست میگم؟؟ ) درست ميگم ؟؟؟؟
بعدش فكر كنم بدترين گزينه استيك اسيد باشه ... تو تو اون محيط NaOH به باز ضعيفتره OAc تبديل ميشه و تيتراسيون از اون چيزي كه تو آب هست هم بد تر ميشه ... اون تامپون شدن آمونياك هم نظريهههههه
سوالاتون خيلي با حالهههه

 تشكررر
تشكررر

يني جواب ميشه فرمالدهيد (همون طور كه فرموديد)
در ضمن فكر كنم منظورتون اين بود تو پست بالا ( مثل این می مونه که بخوایم NH4 رو تو آب با NaOAc تیتر کنیم... درست میگم؟؟ ) درست ميگم ؟؟؟؟
بعدش فكر كنم بدترين گزينه استيك اسيد باشه ... تو تو اون محيط NaOH به باز ضعيفتره OAc تبديل ميشه و تيتراسيون از اون چيزي كه تو آب هست هم بد تر ميشه ... اون تامپون شدن آمونياك هم نظريهههههه
سوالاتون خيلي با حالهههه


kiarash5000 گفت
2رستتت ميفرمايين ... من اصلا حواسم نبود كه قراره حتما NaOH تيتران باشه ... فكر كنم علت اينكه يه اسيد تو محيط آپروتيك قطبي قوي تره اين باشه كه قطب منفي حلال ميره سراغ H اسيدا و باعث ميشه راحت تر كنده بشه و اسيد قوي تري واي3 ( اين يكي تيكيه خودمه
 ) 2رسته ؟؟؟
) 2رسته ؟؟؟
يني جواب ميشه فرمالدهيد (همون طور كه فرموديد)
در ضمن فكر كنم منظورتون اين بود تو پست بالا ( مثل این می مونه که بخوایم NH4 رو تو آب با NaOAc تیتر کنیم... درست میگم؟؟ ) درست ميگم ؟؟؟؟
بعدش فكر كنم بدترين گزينه استيك اسيد باشه ... تو تو اون محيط NaOH به باز ضعيفتره OAc تبديل ميشه و تيتراسيون از اون چيزي كه تو آب هست هم بد تر ميشه ... اون تامپون شدن آمونياك هم نظريهههههه
سوالاتون خيلي با حالهههه

 تشكررر
تشكررر

يني جواب ميشه فرمالدهيد (همون طور كه فرموديد)
در ضمن فكر كنم منظورتون اين بود تو پست بالا ( مثل این می مونه که بخوایم NH4 رو تو آب با NaOAc تیتر کنیم... درست میگم؟؟ ) درست ميگم ؟؟؟؟
بعدش فكر كنم بدترين گزينه استيك اسيد باشه ... تو تو اون محيط NaOH به باز ضعيفتره OAc تبديل ميشه و تيتراسيون از اون چيزي كه تو آب هست هم بد تر ميشه ... اون تامپون شدن آمونياك هم نظريهههههه
سوالاتون خيلي با حالهههه


نه، منظورم همونی بود که نوشتم... آخه آمونیوم تو آمونیاک حکم هیدرونیوم تو آبو داره دیگه...
بدترینشم حق با شماست، استیک اسیده...
- ارسال ها
- 730
- لایک ها
- 521
- امتیاز
- 0
این سوالو از کجا آوردی؟!

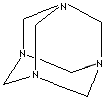
روش فرمالدئید برای اندازه گیری آمونیوم در یک محلول روش معروفیه... فرمالدئید با آمونیوم طبق واکنش زیر، هگزامتیلن تتراآمین میده و هیدرونیوم به راحتی با یه باز قوی تیتر میشه:
 [/center:6707c52ebb]
[/center:6707c52ebb]

روش فرمالدئید برای اندازه گیری آمونیوم در یک محلول روش معروفیه... فرمالدئید با آمونیوم طبق واکنش زیر، هگزامتیلن تتراآمین میده و هیدرونیوم به راحتی با یه باز قوی تیتر میشه:
4NH4[SUP]+[/SUP]+6 HCHO----->(CH2)[SUB]6[/SUB]N[SUB]4[/SUB]+4H[SUP]+[/SUP]+6H[SUB]2[/SUB]O
[center:6707c52ebb]

سلام .بچه ها نمیدونم نقض قوانین ماراتن هست یا نه ولی میخوام چنتا سوال بذارم تو یه پست.متعاقبا" اگر دلخوری پیش بیاد بنده عذر میخوام
ماراتن شروع شد(بووووومب!):
4)pH یک محلول 3% اسید فرمیک(1.0049g/ml) برابر 1.97 است.این محلول را چند مرتبه رقیق کنیم تا درجه یونش آن ده مرتبه افزایش یابد؟
5)در کدام حلال ،قدرت اسیدی HOAC کمتر است؟
1)آمونیاک
2)آب
3)اگزالیک اسید
4)سولفوریک اسید
6)pH محلول و pH نقطه ایزوالکتریک آمینو اسیدی را که دارای ثابت اسیدی
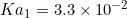 و
و
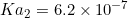 را در محلول 0.1M آن محاسبه کنید.
را در محلول 0.1M آن محاسبه کنید.
7)pH محلول
 توسط دستگاه pH متر کدام عدد را نشان می دهد؟
توسط دستگاه pH متر کدام عدد را نشان می دهد؟
1)1.122
2)1.154
3)1
4)1.140
اینم از سوالات (راستی ترتیب شماره گذاری ایرادی نداره از ماراتن 4 شروع می کنیم آخه آخری
3 بود)خب از هرچه بگذریم سخن شیمی خوش تر است،پس دوستان بسم الله

میم مثه محسن

ماراتن شروع شد(بووووومب!):
4)pH یک محلول 3% اسید فرمیک(1.0049g/ml) برابر 1.97 است.این محلول را چند مرتبه رقیق کنیم تا درجه یونش آن ده مرتبه افزایش یابد؟
5)در کدام حلال ،قدرت اسیدی HOAC کمتر است؟
1)آمونیاک
2)آب
3)اگزالیک اسید
4)سولفوریک اسید
6)pH محلول و pH نقطه ایزوالکتریک آمینو اسیدی را که دارای ثابت اسیدی
7)pH محلول
1)1.122
2)1.154
3)1
4)1.140
اینم از سوالات (راستی ترتیب شماره گذاری ایرادی نداره از ماراتن 4 شروع می کنیم آخه آخری
3 بود)خب از هرچه بگذریم سخن شیمی خوش تر است،پس دوستان بسم الله

میم مثه محسن

- ارسال ها
- 652
- لایک ها
- 568
- امتیاز
- 93
با اجازه ی دوستان،قر و قاطی جواب بدیم! من جوابه سواله پنج رو با شکه بسیار می ذارم! از استدلالم ایراد بگیرید لطفن!

واکنشه HOAC اینه:
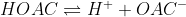
حالا هر چی تو محیط H+ بیشتر باشه، طبقه اصله لوشاتولیه واکنش برگشت بیشتر می شه و در نتیجه قدرته اسیدی HOAC کم تره! حالا تو آمونیاک که آمونیاک بازه و میاد H+ ها رو می گیره و می شه آمونیوم و قدرته اسیدی بگی نگی خوبه!(میگم بگی نگی چون HOAC اسیده خفنی نیست!) تو اسید سولفوریک هم خوده H اسید سولفوریک پتانسیلش زیاده واسه کنده شدن و H+ تو محیط زیاده و قدرته اسیدی HOAC کمه ولی اگزالیک اسید هم اسیده قوییه! و در عینه حال سره اکسیژنی داره که می تونه با تشکیله پیونده هیدروژنی با HOAC اون رو از پا در بیاره به نظرم! واسه همین من گزینه ی سه (اگزالیک اسید) رو انتخاب می کنم!
 درسته؟
درسته؟

واکنشه HOAC اینه:
حالا هر چی تو محیط H+ بیشتر باشه، طبقه اصله لوشاتولیه واکنش برگشت بیشتر می شه و در نتیجه قدرته اسیدی HOAC کم تره! حالا تو آمونیاک که آمونیاک بازه و میاد H+ ها رو می گیره و می شه آمونیوم و قدرته اسیدی بگی نگی خوبه!(میگم بگی نگی چون HOAC اسیده خفنی نیست!) تو اسید سولفوریک هم خوده H اسید سولفوریک پتانسیلش زیاده واسه کنده شدن و H+ تو محیط زیاده و قدرته اسیدی HOAC کمه ولی اگزالیک اسید هم اسیده قوییه! و در عینه حال سره اکسیژنی داره که می تونه با تشکیله پیونده هیدروژنی با HOAC اون رو از پا در بیاره به نظرم! واسه همین من گزینه ی سه (اگزالیک اسید) رو انتخاب می کنم!

- ارسال ها
- 135
- لایک ها
- 22
- امتیاز
- 0
4 ) اگر محلول رو حدودا 118 مرتبه رقيقتر كنيم (حجم آنرا 118 برابر كنيم ) درجه يونش آن 10 برابر ميشود ... ( راه حل بدون تقريب K=a2Co/1-a )
5 ) نميدونم بين آمونياك و سولفوريك اسيد شك دارم
 ... چون از طرفي HOAc تو آمونياك ميشه يون آمونيوم كه قدرت اسيدي كمتري داره واز طرفي p هاي زيادي كه تو محلول سولفوريك اسيد هست محيط رو اشباء كرده و تعادل رو به شدت به سمت چپ ( يني تشكيل استيك اسيد مولكولي ) ميبرهههه ...
... چون از طرفي HOAc تو آمونياك ميشه يون آمونيوم كه قدرت اسيدي كمتري داره واز طرفي p هاي زيادي كه تو محلول سولفوريك اسيد هست محيط رو اشباء كرده و تعادل رو به شدت به سمت چپ ( يني تشكيل استيك اسيد مولكولي ) ميبرهههه ...
6 ) Ph محلول = 1.364 (با تقريب خوب) Ph ايزو الكتريك = 3.845 Ph هم يوني = 3.906 (با تقريب خوب)
7 ) من هر طور ميرن (با رابطه ي دباي-هوگل) ميشه در حدود 1.0985 كه فكر كنم با اين اوصاف بشه گزينه ي 1 ... وليكن رابطه فعاليت وا3 قدرت هاي يوني بالا رو بلد نيسم ...

بازم ممنون به خاطر سوالات خوب و پوزش به خاطر نداشتن راه حل .....

ايشالا كه پاسخ دادن يكجاي همه سوالات تو ماراتون ها جرم نباشههه
 خوش حال ميشم كه اگه اشتباه داشتم كمكم كنين ...
خوش حال ميشم كه اگه اشتباه داشتم كمكم كنين ...
5 ) نميدونم بين آمونياك و سولفوريك اسيد شك دارم

6 ) Ph محلول = 1.364 (با تقريب خوب) Ph ايزو الكتريك = 3.845 Ph هم يوني = 3.906 (با تقريب خوب)
7 ) من هر طور ميرن (با رابطه ي دباي-هوگل) ميشه در حدود 1.0985 كه فكر كنم با اين اوصاف بشه گزينه ي 1 ... وليكن رابطه فعاليت وا3 قدرت هاي يوني بالا رو بلد نيسم ...

بازم ممنون به خاطر سوالات خوب و پوزش به خاطر نداشتن راه حل .....

ايشالا كه پاسخ دادن يكجاي همه سوالات تو ماراتون ها جرم نباشههه

- ارسال ها
- 135
- لایک ها
- 22
- امتیاز
- 0
سوال چهارم كه راه حلش خيلي طولانيه حو3له نوشتنشو ندارم ... ولي سر نخشو تو پرانتز نوشتم ... سوال 6 رو هم بابا بيخيال من كه دقيق رفتم بدونه احتساب پروتون دوم ( كه اسن 2رستشم همينه )شد هموني كه نوشتم ... سوال هشتم هم نداريمكه آخه شما گفتي كه ... ولي اگه منظورتون سوال نهه اونو بلد نيسم اگه ميشه كمك كنين ...

و اما كمك به شكستن يخ تاپيك (( يخ حوض ميشكنيم ...
 ))
))
8 )) محلولي نسبت به Ag2CrO4 و Ag2Cr2O4 اشباع ميباشد ... غلظت يون Ag در اين محلول چقدر است ؟؟ Ksp (Ag2Cr2O4 ) = 6exp-12 Ksp (Ag2CrO4 ) = 9exp-12
9 )) محلولي از H2SO4 با Ph=3 داريم . اگر آنرا 10 مرتبه رقيق كنيم Ph جديد آنرا به دست آوريد ؟؟ ( اينيكي خيلي خوفه روش فكر كنين )
گزينه هارو نزاشتم بمونين تو خماري ...


و اما كمك به شكستن يخ تاپيك (( يخ حوض ميشكنيم ...

8 )) محلولي نسبت به Ag2CrO4 و Ag2Cr2O4 اشباع ميباشد ... غلظت يون Ag در اين محلول چقدر است ؟؟ Ksp (Ag2Cr2O4 ) = 6exp-12 Ksp (Ag2CrO4 ) = 9exp-12
9 )) محلولي از H2SO4 با Ph=3 داريم . اگر آنرا 10 مرتبه رقيق كنيم Ph جديد آنرا به دست آوريد ؟؟ ( اينيكي خيلي خوفه روش فكر كنين )
گزينه هارو نزاشتم بمونين تو خماري ...

سئوال 5 من نمی دونم مشکلش چیه!! خب چون سولفوریک اسید از همه قویتره، میشه همون!! تو آمونیاک با توجه به اینکه استیک اسید از اسید مزدوج حلال (یعنی آمونیوم) قویتره، پس حلال اثر همتراز کنندگی روش داره و براش اسید قوی حساب میشه!! مثل HCl تو آب که همش تبدیل میشه به هیدرونیوم که اسید مزدوج حلاله!!
سئوال 6:
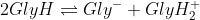
^{2};(x);;;(x))
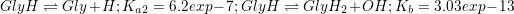
=-log(f)-log(|H^{+}|)=\frac{0.51\sqrt{\mu }}{1+\sqrt{\mu }}+1=1.156\approx 1.154)
سئوال 6:
pK معادله رو با کم کردن pK1 از pK2 بدست میاریم. بعد براش رابطه ثابت تعادل رو (بر حسب همون x هایی که زیر هر گونه نوشتم) می نویسیم، pk میشه 4.73، x میشه
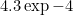 . pH رو از هرکدوم از بافرها حساب می کنیم، میشه 3.844!! این مال ایزو الکتریک که غلظت Gly و GlyH2 رو برابر گرفتیم و دقیق دقیق حلش کردیم!! حالا کجاش غلطه؟؟
. pH رو از هرکدوم از بافرها حساب می کنیم، میشه 3.844!! این مال ایزو الکتریک که غلظت Gly و GlyH2 رو برابر گرفتیم و دقیق دقیق حلش کردیم!! حالا کجاش غلطه؟؟
قسمت دوم سئوال هم داریم:
پس از آبکافتش در مقابل اونیکی صرفنظر میکنیم، حالا pH رو به سادگی حساب می کنیم، میآد 3.60!!
سئول 7 هم اول قدرت یونی رو حساب می کنیم، میشه 0.2... پس f رو باید از رابطه EDHE بدستش بیاریم... میذاریم تو رابطه:

