- ارسال ها
- 92
- لایک ها
- 73
- امتیاز
- 0
پاسخ : تاثیر ضرایب واکنش تو ثابت تعادل
شما وقتی تو آزمایشگاه ۱۰ مول از دو تا واکنش دهنده رو با هم واکنش می دی اون وقت k رو به دست میاری بعد دوباره تو یه ظرف دیگه دوباره همون هارو با هم واکنش می دی ، خب حالا نقش معادله این وسط چیه ؟ این دو تا واکنش که هیچ فرقی نکرد ولی k تغییر کرد! دلتا جی هم تغییر نکرد.
چرا 10 نذارم ؟ مگه مقدار ماده اولیه تغییر کرده ؟
وقتی ضرایب واکنش رو دو برابر کنید دلتا G هم دو برابر می شه که این رو از هس هم می شه فهمید . حالا اگه انرژی آزاد گیبس یه واکنش رو نسبت به انرژی آزاد همون واکنش با ضرایب دو برابر مقایسه کنیم(با همون رابطه
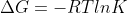 ) باز هم به رابطه
) باز هم به رابطه
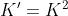 می رسیم و بقیش هم مثل پستای قبلی که گفتم. کلا مشکلایی که اینجا می بینید به خاطر اینه که توی یه واکنش باید ساده ترین ضرایب صحیح رو انتخاب کنید.
می رسیم و بقیش هم مثل پستای قبلی که گفتم. کلا مشکلایی که اینجا می بینید به خاطر اینه که توی یه واکنش باید ساده ترین ضرایب صحیح رو انتخاب کنید.
وقتی ضرایب واکنش رو دو برابر کنید دلتا G هم دو برابر می شه که این رو از هس هم می شه فهمید . حالا اگه انرژی آزاد گیبس یه واکنش رو نسبت به انرژی آزاد همون واکنش با ضرایب دو برابر مقایسه کنیم(با همون رابطه
