- ارسال ها
- 652
- لایک ها
- 568
- امتیاز
- 93
گرافیت هر حلقش 3تا پیوند دوگانه نداره!!! فک کردم که رو هر کربنش چون یه الکترونه غیر مستقره که بین لایه ها جاذبه برقرار می کنه،بعد از تصعید این نیرویه جاذبه از بین می ره و الکترونا می رن خونه هاشون رو کربناشون! این الکترون ها هم واسه رادیکالی نبودن میان و دو به دو جفت می شن و پیوند رو دو گانه می کنند، پس اگه این درست باشه پیوندا یکی در میون دوگانه می شه!!!
اگه این درست باشه، تو این ساختار پیوندا نه 2 هستند، نه 1!!!(هیبرید رزونانسی دو ساختار رزونانسی که به وجود می آد) ولی ما داریم از آنتالپی پیوند دوگانه استفاده می کنیم، پس ما از مقداره تجربی عدده بزرگتری در میاریم!!! چون شکستنه پیوند 1.5 گانه انرژی کمتری آزاد می کنه تا دوگانه!
از نظر ترمودینامیکی:
تعداد پیوندایه الماس که تو سوختنش می شکنه بیشتره و گرمایه بیشتری آزاد می کنه و
از نظر قیمت الماس خیلی خیلی گرون تر از گرافیته!

طریقه ی محاسبه رو که بالا توضیح دادم. ما داریم فرض می کنیم که پیوندا دوگانه اند (اطلاعاته مساله این طور ایجاب می کنه!) پس 6*n تا پیوند دوگانه داریم که n تعداد حلقه هاست! پس با شکستنه این پیوندا 6*n*B انرژی آزاد می شه! واسه تصعید هم A !!!
پس روی هم می شه
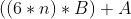
اگه این درست باشه، تو این ساختار پیوندا نه 2 هستند، نه 1!!!(هیبرید رزونانسی دو ساختار رزونانسی که به وجود می آد) ولی ما داریم از آنتالپی پیوند دوگانه استفاده می کنیم، پس ما از مقداره تجربی عدده بزرگتری در میاریم!!! چون شکستنه پیوند 1.5 گانه انرژی کمتری آزاد می کنه تا دوگانه!
از نظر ترمودینامیکی:
تعداد پیوندایه الماس که تو سوختنش می شکنه بیشتره و گرمایه بیشتری آزاد می کنه و
از نظر قیمت الماس خیلی خیلی گرون تر از گرافیته!

طریقه ی محاسبه رو که بالا توضیح دادم. ما داریم فرض می کنیم که پیوندا دوگانه اند (اطلاعاته مساله این طور ایجاب می کنه!) پس 6*n تا پیوند دوگانه داریم که n تعداد حلقه هاست! پس با شکستنه این پیوندا 6*n*B انرژی آزاد می شه! واسه تصعید هم A !!!
پس روی هم می شه



