سلام
میخواستم بدونم چرا اگه معادله رو یه ضریب ضرب کنیم ، ثابت تعادل معادله جدید ، ثابت تعادل قبلی به توان ضریب میشه؟
مگه سازو کار واکنش تغییر میکنه؟
نسبت مولی ها هم که یکین.
مثلاً :
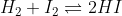 و
و
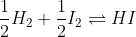
این دو تا واکنش نسبت مولیا یکین و همه چیشون یکیه !
اما ثابت تعادل اولی مجذور دومیه ! چرا؟
مثلاً توی دو ظرف یه لیتری مشابه یه مول HI میریزیم ( تو هر کدوم )
یکی رو بر اساس واکنش اول ، یکی دوم
کدوم به کدومه؟
اصلاً چرا اینه؟
چه وضعشه ! :4: چرا اینا فرق دارن :4:
مگه اتفاقی که تو این ظرف میوفته ، تو اون نمی افته؟
میخواستم بدونم چرا اگه معادله رو یه ضریب ضرب کنیم ، ثابت تعادل معادله جدید ، ثابت تعادل قبلی به توان ضریب میشه؟
مگه سازو کار واکنش تغییر میکنه؟
نسبت مولی ها هم که یکین.
مثلاً :
این دو تا واکنش نسبت مولیا یکین و همه چیشون یکیه !
اما ثابت تعادل اولی مجذور دومیه ! چرا؟
مثلاً توی دو ظرف یه لیتری مشابه یه مول HI میریزیم ( تو هر کدوم )
یکی رو بر اساس واکنش اول ، یکی دوم
کدوم به کدومه؟
اصلاً چرا اینه؟
چه وضعشه ! :4: چرا اینا فرق دارن :4:
مگه اتفاقی که تو این ظرف میوفته ، تو اون نمی افته؟

